Строение атома вещества определяется расположением электронов на его энергетических уровнях. Внешний энергетический уровень атома, также называемый валентным уровнем, играет решающую роль во взаимодействии атомов между собой. Этот уровень содержит определенное количество электронов, которые определяют химические свойства вещества.
Неметаллы и металлы отличаются друг от друга как в физических, так и в химических свойствах. Валентные электроны на внешнем энергетическом уровне в неметаллах обычно больше, чем у металлов. Это связано с особенностями строения атомов.
Валентные электроны в атоме металла находятся на последнем слое энергетического уровня и могут быть от одного до трех. Одновалентные металлы имеют один валентный электрон, двувалентные - два, а трехвалентные - три валентных электрона на внешнем слое. В свою очередь, неметаллы имеют валентные электроны на последнем энергетическом уровне от трех до восьми. Это говорит о том, что неметаллы обладают большей потенциальной энергией и, следовательно, большей активностью во время химических реакций.
Атомы металлов и неметаллов
Один из основных различий между атомами металлов и неметаллов заключается в количестве электронов на их внешнем энергетическом уровне. Атомы металлов обычно имеют меньше электронов на внешнем слое, чем атомы неметаллов.
Металлы, как правило, имеют одно или два электрона на внешнем энергетическом уровне, что делает их намного более реактивными и способными образовывать ионы, чем атомы неметаллов. Металлы образуют положительно заряженные ионы, как потеряв электрон(ы), так и сдвинув электрон(ы) с внешнего уровня на внутренний.
С другой стороны, неметаллы обычно имеют от трех до восьми электронов на внешнем энергетическом уровне. Это делает их более стабильными и менее склонными к потере электронов. Вместо этого, они обычно образуют отрицательно заряженные ионы, захватывая или разделяя электрон(ы) с других атомов.
Исключениями являются некоторые переходные металлы, которые могут иметь более сложную электронную конфигурацию и большее количество электронов на внешнем слое.
Осознание этого различия между атомами металлов и неметаллов помогает понять их химические свойства и способность взаимодействовать с другими элементами.
Сравнение количества электронов на внешнем слое
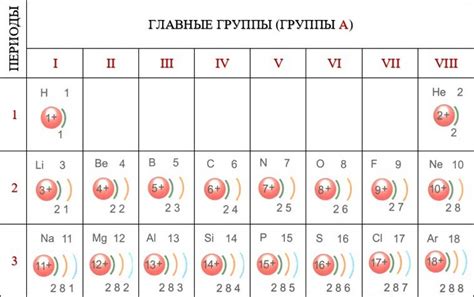
Атомы металлов и неметаллов имеют различное количество электронов на внешнем слое. Это связано с их различными свойствами и структурой атомов.
Обычно вещества, относящиеся к металлам, имеют малое количество электронов на внешнем слое. Например, атомы натрия имеют один электрон на внешнем энергетическом уровне, кальция - два, железа - две или три. Это делает металлы хорошими проводниками электричества и тепла.
Неметаллы, напротив, имеют большее количество электронов на внешнем слое. Например, атомы кислорода имеют шесть электронов на внешнем энергетическом уровне, фтора - семь, хлора - семь. Большое количество электронов на внешнем слое делает неметаллы несколько более реактивными и склонными к образованию ковалентных связей.
Электроны на внешнем слое влияют на химические свойства атомов и их способность образовывать химические соединения. Металлы и неметаллы часто образуют соединения друг с другом, где металлы отдают электроны неметаллам, чтобы достичь стабильной конфигурации электронов.
Свойства металлов

Электронная структура. Атомы металлов имеют меньшее количество электронов на внешнем слое по сравнению с неметаллами. Как правило, у металлов внешний слой содержит от 1 до 3 электронов, что обеспечивает им способность образовывать ионные связи, а также осуществлять электронный обмен с другими атомами.
Проводимость электричества и тепла. Одним из основных свойств металлов является их хорошая проводимость электричества и тепла. Это связано с физической природой свободных электронов в металлической сетке. Благодаря наличию свободных электронов, металлы способны передавать электрический ток и тепло с малыми потерями энергии.
Металлический блеск. Визуальное свойство металлов - их блеск. Обычно металлы имеют высокую отражательную способность и светлоотражающую поверхность. Это объясняется способностью свободных электронов поглощать и перераспределять свет, что придает металлам блестящий вид.
Пластичность и способность к деформации. Металлы обладают высокой пластичностью, что позволяет им быть легко деформируемыми. Они могут быть прокатаны, вытянуты или смещены без разрушения. Это свойство обусловлено подвижностью свободных электронов и слагаемыми внутренними силами в металлической структуре.
Высокая плотность. Металлы обладают высокой плотностью по сравнению с неметаллами. Это связано с компактностью и плотностью металлической сетки.
Высокая температура плавления и кипения. Большинство металлов характеризуются высокой температурой плавления и кипения. Это связано с сильными межатомными связями в металлической сетке, которые требуют большого количества энергии для разрыва.
Магнитные свойства. Некоторые металлы обладают магнитными свойствами. Например, железо, никель и кобальт являются ферромагнетиками, то есть они обладают способностью притягиваться или отталкиваться в магнитном поле.
Свойства неметаллов

Неметаллы - это группа химических элементов, обладающих определенными химическими и физическими свойствами. Они обычно образуют отрицательно заряженные ионы, принимая дополнительные электроны из-за их меньшего количества на внешнем энергетическом уровне.
Неметаллы имеют высокую электроотрицательность, что говорит о их способности притягивать электроны. Из-за этой способности они образуют ковалентные связи, в которых электроны общие для нескольких атомов. Ковалентные связи позволяют неметаллам образовывать молекулы.
Один из важных факторов, отличающих неметаллы от металлов, - это их низкая электропроводность. На внешнем слое неметаллов находятся несколько электронов, которые удерживаются атомами более сильно, чем в металлах. Именно это обусловливает их низкую электропроводность и невозможность передачи электрического тока без ионизации.
Некоторые неметаллы, такие как кислород, хлор и азот, обладают высокой реактивностью и могут образовывать сильные окислители. Они способны вступать в химические реакции, в которых они передают электроны другим элементам, проявляя окислительные свойства.
Большинство неметаллов являются газами или твердыми веществами при комнатной температуре и обычных условиях давления. В таблице элементов они находятся справа от столбца с металлами.
Сравнение количества электронов на внешнем слое металлов и неметаллов
Количество электронов на внешнем слое атома определяет его химические свойства и способность участвовать в химических реакциях. Металлы и неметаллы отличаются по количеству электронов на внешнем слое.
Металлы обычно имеют малое количество электронов на внешнем слое, обычно один или два. Это делает их металлическими свойствами, такими как хорошая электропроводность и плавление при высоких температурах. Это связано с тем, что металлы стремятся отдать эти электроны и образовать положительный ион. Например, кальций имеет два электрона на внешнем слое и может легко отдать их, образуя положительный ион Ca2+.
В отличие от металлов, неметаллы обычно имеют большое количество электронов на внешнем слое, от трех до восьми. Это делает их неметаллическими свойствами, такими как плохая электропроводность и высокие температуры плавления. Неметаллы стремятся получить недостающие электроны, чтобы заполнить свой внешний слой и образовать отрицательные ионы. Например, кислород имеет шесть электронов на внешнем слое и может получить два электрона, образуя отрицательный ион O2-.
Однако, следует отметить, что существуют вещества, которые находятся посередине между металлами и неметаллами и называются полуметаллами или металлоидами. У них обычно от двух до четырех электронов на внешнем слое, что позволяет им образовывать как положительные, так и отрицательные ионы.
Влияние количества электронов на свойства веществ
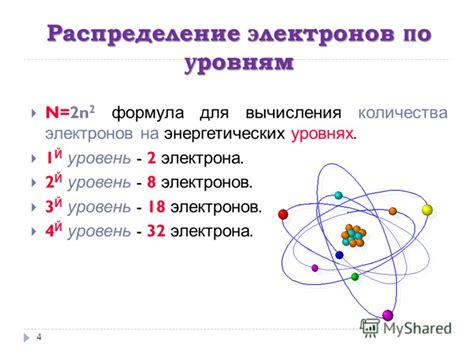
Количество электронов на внешнем слое атома влияет на его свойства и способность образовывать соединения. Особенно важное значение имеет количество электронов валентной оболочки - внешней электронной оболочки атома.
Металлы имеют меньше электронов на внешнем слое, что делает их хорошими проводниками электричества и тепла. Это связано с тем, что электроны на внешней оболочке свободно движутся между атомами металла, образуя электронное облако. Это обеспечивает возможность перемещения заряда и создает условия для проводимости.
Однако неметаллы имеют больше электронов на внешнем слое, что делает их плохими проводниками электричества и тепла. Неметаллы обычно образуют ковалентные связи. В них электроны между атомами не могут свободно перемещаться, так как они заняты образованием связей. В результате неметаллы обладают высокой степенью несоединительности.
Но неметаллы обладают другими важными свойствами. Например, некоторые неметаллы образуют положительные и отрицательные ионы, что позволяет им образовывать ионообменные соединения. Кроме того, неметаллы обладают высокой электроотрицательностью и способностью вступать в реакции окисления-восстановления. В самом деле, благодаря своей способности принимать или отдавать электроны, неметаллы могут образовывать широкий спектр химических соединений.
Какие атомы имеют больше электронов на внешнем слое?

Атомы металлов и неметаллов имеют различное количество электронов на внешнем слое. Внешний слой, также известный как валентная оболочка, содержит электроны, которые определяют химические свойства атома.
Металлы, как правило, имеют меньше электронов на внешнем слое. Они стремятся отдавать эти электроны, чтобы достичь стабильной конфигурации. Это связано с тем, что металлы находятся слева в таблице Менделеева и имеют низкую электроотрицательность. Примерами металлов являются железо, алюминий, натрий и калий.
Неметаллы, напротив, имеют больше электронов на внешнем слое. Они имеют высокую электроотрицательность и стремятся получить или разделить электроны, чтобы достичь стабильной конфигурации. Некоторые неметаллы также имеют "половину заполненного" внешнего слоя, что делает их особенно реактивными. Примерами неметаллов являются кислород, хлор, сера и фтор.
Интересно отметить, что существует группа элементов, называемая полупроводниками, которая находится между металлами и неметаллами. Они имеют промежуточное количество электронов на внешнем слое и могут проявлять свойства обоих. Примером полупроводников является кремний, который широко используется в электронике.
Вопрос-ответ

Какие атомы имеют больше электронов на внешнем слое: металлы или неметаллы?
На внешнем слое атомы неметаллов имеют обычно больше электронов по сравнению с металлами.
Какой тип атомов имеет большее количество электронов на внешнем слое: металлов или неметаллов?
Неметаллы обычно имеют большее количество электронов на внешнем слое в сравнении с металлами.
Почему атомы неметаллов обычно имеют больше электронов на внешнем слое, чем металлы?
Это связано с электронной конфигурацией атомов. Неметаллы имеют склонность к заполнению внешнего энергетического уровня, что обусловлено их высокой электроотрицательностью. В то же время, металлы имеют способность отдавать электроны, поэтому количество электронов на их внешнем слое обычно меньше.
