Электронная конфигурация атома — это упорядоченное распределение электронов в различных энергетических уровнях и орбиталях вокруг ядра атома. Электронная конфигурация играет важную роль в химических свойствах элементов, включая щелочные металлы.
Щелочные металлы — это группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой реакционной способностью и легкостью ионизации. Это связано с их особым электронным строением.
Каждый атом щелочного металла имеет один электрон в своей внешней энергетической оболочке (оболочке n). Этот электрон отвечает за химическую реактивность металла и его готовность отдать этот электрон другому атому. Поэтому щелочные металлы легко образуют положительные ионы, передавая свой внешний электрон.
Электронная конфигурация атомов щелочных металлов можно записать в следующем виде: ns1, где n обозначает номер энергетического уровня, на котором находится внешняя оболочка, а число 1 указывает на наличие одного электрона на этом уровне. Например, электронная конфигурация атома лития — 1s2 2s1, а атома калия — 1s2 2s2 2p6 3s2 3p6 4s2.
Значение электронной конфигурации
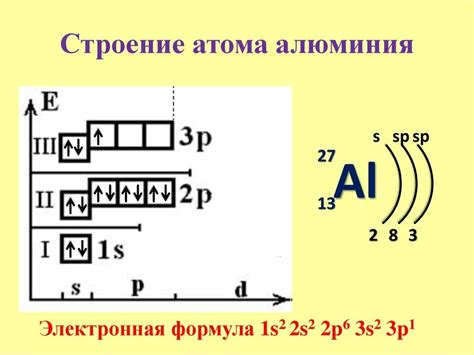
Электронная конфигурация атомов щелочных металлов играет важную роль в их химических свойствах и реактивности. Она определяет, какие уровни энергии в атоме заполнены электронами и какие энергетические уровни доступны для связывания с другими атомами.
Электронная конфигурация щелочных металлов характеризуется наличием одного электрона во внешней оболочке, обозначаемой как s-подуровень. Такая конфигурация делает их очень реактивными и склонными к образованию ионов положительного заряда.
Скопление одного электрона во внешней оболочке делает щелочные металлы отличными веществами для осуществления реакций с водой и кислородом. Например, при контакте с водой они могут образовывать гидроксиды соответствующих металлов и выделяться водородный газ.
Электронная конфигурация также влияет на физические свойства щелочных металлов, такие как плавкость и точка кипения. Поскольку электроны во внешней оболочке слабо связаны с ядром, щелочные металлы обладают низкими точками плавления и кипения.
Определение и применение

Электронная конфигурация атомов щелочных металлов – это распределение электронов в энергетических уровнях этих атомов. Щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются наличием одного электрона в своей внешней энергетической оболочке.
Электронная конфигурация атомов щелочных металлов играет важную роль в понимании их свойств и реакций. Знание конфигурации электронов позволяет установить возможность образования химических связей с другими элементами и предсказывать химическую активность данных металлов. Например, наличие одного электрона во внешней оболочке делает щелочные металлы очень реакционноспособными, они легко образуют ионные соединения с другими элементами.
Кроме того, электронная конфигурация атомов щелочных металлов определяет их физические и химические свойства. Например, наличие одного электрона во внешней оболочке сильно влияет на важную характеристику – электронную проводимость. Щелочные металлы являются хорошими проводниками электричества, так как их электроны могут легко передвигаться между атомами.
Кроме того, щелочные металлы активно применяются в различных областях. Например, они используются для производства одноразовых батареек и аккумуляторов, а также в процессе обработки стекла и керамики. Они также находят широкое применение в фармацевтической и пищевой промышленности, а также в некоторых технических процессах, связанных с осветительными приборами и катодами.
Электронная конфигурация щелочных металлов

Электронная конфигурация атома определяет расположение электронов в его электронных оболочках. Это важное свойство, которое определяет химические свойства атома. Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, имеют определенную электронную конфигурацию.
Электронная конфигурация щелочных металлов характеризуется наличием одного электрона в последней энергетической оболочке (s-оболочке). Например, литий имеет электронную конфигурацию 1s2 2s1, где 1s и 2s - энергетические оболочки, а верхние цифры обозначают количество электронов в каждой оболочке. Таким образом, литий имеет 2 электрона в его первой оболочке и 1 электрон во второй оболочке.
Подобным образом, натрий (Na) имеет электронную конфигурацию 1s2 2s2 2p6 3s1. То есть, натрий имеет 2 электрона в первой оболочке, 6 электронов во второй и 1 электрон в третьей оболочке.
Как видно, щелочные металлы имеют электронную конфигурацию, в которой последняя энергетическая оболочка содержит только один электрон. Это делает их очень реактивными, так как они стремятся избавиться от этого одиночного электрона путем образования химических связей с другими атомами. В результате этого процесса, атомы щелочных металлов наполняют свою последнюю энергетическую оболочку и становятся более устойчивыми.
В заключении, электронная конфигурация щелочных металлов характеризуется наличием одного электрона в последней энергетической оболочке. Это делает атомы щелочных металлов реактивными и способными образовывать химические соединения с другими атомами. Понимание электронной конфигурации помогает объяснить химические свойства щелочных металлов и их важность в различных сферах науки и промышленности.
Система нумерации электронных оболочек

Система нумерации электронных оболочек в атомах щелочных металлов основывается на принципе полной заполненности оболочек перед переходом к следующей. Каждая оболочка обозначается буквой, а каждый электрон в оболочке получает числовое значение.
Первая оболочка, ближайшая к ядру атома, обозначается буквой K. Здесь находится только одно электронное место с номером 1. Вторая оболочка обозначается буквой L и содержит 8 электронных мест: 2, 3, 4, 5, 6, 7, 8 и 9. Третья оболочка обозначается буквой M и содержит 18 электронных мест: 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 и 27.
Система нумерации оболочек продолжается далее в алфавитном порядке. Например, ущелочных металлов, таких как натрий (Na) и калий (K), первые две электронные оболочки заполнены и имеют следующие электронные номера: K (1 электрон), L (2 электрона) и, соответственно, M (8 электронов). Таким образом, электронная конфигурация натрия: 1s^22s^22p^63s^1, а электронная конфигурация калия: 1s^22s^22p^63s^23p^64s^1.
Система нумерации электронных оболочек помогает визуально представить распределение электронов в атоме щелочных металлов и понять связанные с этим химические свойства и реактивность.
Примеры электронной конфигурации щелочных металлов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, расположены в первой группе периодической системы элементов. Все они обладают сходными химическими свойствами и образуют легко ионизирующиеся положительные ионы с однозначным зарядом +1. Электронная конфигурация щелочных металлов может быть описана с использованием нотации элементов и электронных оболочек.
Например, электронная конфигурация лития будет выглядеть как 1s2 2s1. Это означает, что в атоме лития на первом энергетическом уровне расположено 2 электрона, а на втором энергетическом уровне – 1 электрон. Такая конфигурация обусловливает его химические свойства и возможность образования иона Li+.
Атомы натрия имеют электронную конфигурацию 1s2 2s2 2p6 3s1. На первом энергетическом уровне расположено 2 электрона, на втором – 8 электронов, а на третьем – 1 электрон. Из-за наличия одного электрона в внешней оболочке, натрий легко ионизируется и образует положительный ион Na+.
Калий имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s1. На первом энергетическом уровне находятся 2 электрона, на втором – 8 электронов, на третьем – 8 электронов, а на четвертом – 1 электрон. Электронная конфигурация калия обуславливает его химические свойства и способность образовывать положительный ион K+.
Рубидий имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1. На первом энергетическом уровне находятся 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, на четвертом – 8 электронов и на пятом – 1 электрон. Рубидий образует положительные ионы Rb+.
Цезий имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1. На первом энергетическом уровне находятся 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, на четвертом – 18 электронов, на пятом – 8 электронов и на шестом – 1 электрон. Ион цезия имеет заряд Cs+.
Квантовые числа электронной конфигурации

Квантовые числа представляют собой значения, которые определяют возможные значения энергии электронов в атоме. Они помогают описать электронную конфигурацию атомов щелочных металлов, таких как литий, натрий, калий и другие.
Первое квантовое число, известное как главное квантовое число (n), определяет энергетический уровень электрона. Все значения этого числа должны быть положительными целыми числами, начиная от 1. Чем больше значение n, тем выше энергетический уровень.
Второе квантовое число, известное как орбитальное квантовое число (l), определяет форму орбитали. Оно может принимать значения от 0 до n-1. Например, если значение n равно 3, то возможные значения l будут 0, 1 и 2. Каждое значение l соответствует определенной форме орбитали, такой как шарообразная (l=0), плоская (l=1) или двойной по форме (l=2).
Третье квантовое число, известное как магнитное квантовое число (ml), определяет ориентацию орбитали в пространстве. Оно может принимать значения от -l до l. Например, если значение l равно 2, то возможные значения ml будут -2, -1, 0, 1 и 2. Каждое значение ml соответствует определенной ориентации орбитали в пространстве.
Четвертое квантовое число, известное как спиновое квантовое число (ms), определяет направление вращения электрона вокруг своей оси. Оно может принимать значения +1/2 или -1/2. Положительное значение обозначает, что электрон вращается в одном направлении, а отрицательное значение - в другом направлении.
Таким образом, зная значения квантовых чисел, можно определить полную электронную конфигурацию атома щелочного металла. Например, для атома лития с атомным номером 3, его электронная конфигурация будет следующей: 1s2 2s1, где 1s и 2s - орбитали, а числа 2 и 1 соответствуют значениям главного и орбитального квантовых чисел соответственно.
Определение и значение квантовых чисел
Квантовые числа - это числовые значения, которые описывают энергетические уровни и орбитали электрона в атоме. Они позволяют точно определить расположение электрона вокруг ядра и его энергетическое состояние.
Главное квантовое число (n) определяет энергетический уровень, на котором находится электрон. Чем больше значение n, тем больше энергия уровня и размер орбитали.
Орбитальное квантовое число (l) определяет форму орбитали электрона. Может принимать значения от 0 до n-1. Например, для энергетического уровня n=2 орбитальное квантовое число может быть равно 0 или 1.
Магнитное квантовое число (ml) определяет ориентацию орбитали электрона в пространстве относительно внешнего магнитного поля. В зависимости от значения ml могут возникать различные формы орбиталей.
Спиновое квантовое число (ms) определяет направление вращения электрона вокруг своей оси. Может принимать значения +1/2 или -1/2. Это число определяет магнитные свойства электрона.
Знание квантовых чисел позволяет не только определить электронную конфигурацию атомов щелочных металлов, но и прогнозировать химические свойства веществ. Квантовые числа являются основой для понимания квантовой механики и атомной структуры, а их правильное использование позволяет делать точные прогнозы в химии и физике.
Вопрос-ответ

Какова электронная конфигурация атомов щелочных металлов?
Электронная конфигурация атомов щелочных металлов характеризуется наличием одного электрона в внешней энергетической оболочке. Например, электронная конфигурация атома лития (Li) составляет 1s2 2s1, а электронная конфигурация атома натрия (Na) - 1s2 2s2 2p6 3s1.
Какая важность электронной конфигурации атомов щелочных металлов?
Электронная конфигурация атомов щелочных металлов является основой для понимания их химических свойств и реакций. Она определяет возможность этих атомов участвовать в химических соединениях, образовании и разрыве связей с другими атомами. Также, электронная конфигурация влияет на физические свойства щелочных металлов, такие как точка плавления и кипения, плотность и теплопроводность.
Что такое внешний электронный уровень атома?
Внешний электронный уровень атома - это энергетическая оболочка, на которой находится последний (внешний) электрон в электронной конфигурации. Этот электрон определяет химические свойства и реактивность атома, так как он может участвовать в образовании химических соединений и взаимодействовать с другими атомами.
Какие элементы относятся к группе щелочных металлов?
В группу щелочных металлов входят элементы, находящиеся в первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они все имеют одну общую характеристику - наличие одного электрона в внешней энергетической оболочке и легко вступают в химические реакции.
