Алюминий – это химический элемент с атомным номером 13 и обозначением Al. Он принадлежит к группе III периодической системы элементов и является третьим по распространенности металлом на Земле. Алюминий обладает рядом уникальных физических и химических свойств, которые обусловлены его строением атомов.
Атом алюминия состоит из ядра, в котором содержатся 13 протонов и обычно 14 нейтронов. Вокруг ядра находятся электроны, которые образуют облако электронов. Каждый атом алюминия имеет 3 электрона на внешнем энергетическом уровне, а значит, он относится к группе элементов с трехвалентным ионом. Отсутствие одного электрона, чтобы заполнить четвертую оболочку, является причиной активности алюминия в химических реакциях.
Строение атомов алюминия определяет его физические и химические свойства. Например, благодаря своим малым размерам и высокой плотности алюминий обладает высокой прочностью и жаростойкостью. Кроме того, его электронная структура позволяет атомам алюминия образовывать ковалентные и ионные связи с другими атомами, что способствует образованию различных соединений и сплавов.
Атомы алюминия играют важную роль в свойствах этого металла. Они обеспечивают его легкость, хорошую проводимость электричества и тепла, а также устойчивость к окислению. Благодаря своей электродонорной природе, алюминий может вступать в реакцию с оксидами и образовывать непроницаемую пленку оксида алюминия, которая предотвращает дальнейшую коррозию.
Строение атомов алюминия и их способность вступать в различные химические реакции делают этот металл востребованным во многих отраслях промышленности, включая авиацию, строительство и упаковку. Понимание строения атомов алюминия и их роли в формировании свойств этого металла является ключевым фактором для разработки новых материалов и улучшения его свойств в целом.
Строение атомов алюминия
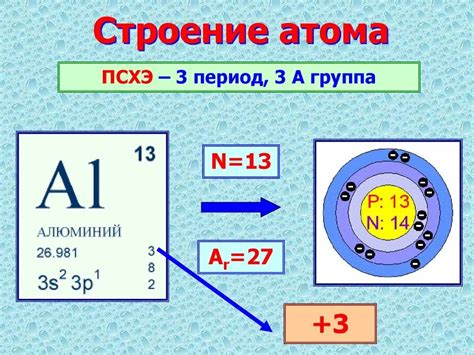
Алюминий - это химический элемент, символ Al, атомный номер 13. Он относится к группе IIIA периодической таблицы элементов и является третьим самым распространенным элементом на Земле. Атом алюминия состоит из 13 электронов, расположенных в трех энергетических оболочках.
Внутри атома алюминия находится ядро, состоящее из 13 протонов и различного числа нейтронов. Протоны обладают положительным зарядом, тогда как нейтроны не имеют заряда. Количество электронов в атоме алюминия равно количеству протонов, что делает его электрически нейтральным.
Электроны распределены вокруг ядра в разных электронных оболочках. Внутренняя оболочка содержит 2 электрона, вторая оболочка - 8 электронов, а последняя оболочка, называемая внешней оболочкой, содержит 3 электрона. Такая конфигурация оболочек делает атом алюминия особо стабильным и мало склонным к химическим реакциям.
Благодаря своей структуре, атому алюминия свойственны некоторые уникальные химические и физические свойства. Например, алюминий обладает высокой прочностью и легкостью, что делает его идеальным материалом для множества промышленных и строительных приложений. Он также обладает высокой теплопроводностью и электропроводностью, что делает его полезным во многих электронных и электротехнических устройствах.
- Алюминий можно легко обработать, а также окрашивать и покрывать защитным слоем, что позволяет создавать разнообразные изделия различных форм и цветов.
- Строение атомов алюминия также делает его устойчивым к коррозии. Внешний оксидный слой образуется на поверхности алюминия, который защищает его от воздействия окружающей среды и предотвращает дальнейшую окислительную реакцию.
В целом, строение атомов алюминия играет важную роль в его уникальных химических и физических свойствах, делая его одним из самых полезных и распространенных металлов в мире.
Электронная оболочка атомов

Электронная оболочка атома алюминия состоит из трех энергетических уровней - первого, второго и третьего. Каждый энергетический уровень имеет определенное количество подуровней, на которых расположены электроны. Первый уровень может вместить до 2 электронов, второй - до 8 электронов, а третий - до 8 электронов.
Электронная оболочка атомов алюминия определяет его химические свойства. Благодаря особенностям строения электронной оболочки, алюминий обладает высокой химической активностью и способностью образовывать соединения с другими элементами. Это связано с тем, что алюминий старается заполнить свою внешнюю оболочку электронами, чтобы достичь стабильного состояния.
Наличие трех энергетических уровней в электронной оболочке атомов алюминия создает дополнительные возможности для образования соединений. Например, каждый атом алюминия может образовывать до трех ковалентных связей с другими атомами за счет своих электронов во внешней оболочке. Это позволяет алюминию образовывать широкий спектр соединений и растворяться в различных реагентах.
В целом, электронная оболочка атомов алюминия играет ключевую роль в его химических свойствах и влияет на его взаимодействие с другими элементами. Это делает алюминий важным и широко используемым металлом в различных отраслях промышленности.
Ядро атома алюминия

Ядро атома алюминия состоит из 13 протонов и переменного числа нейтронов. Протоны - это элементарные частицы, обладающие положительным электрическим зарядом. Они находятся в центре атома и определяют его химические свойства.
Нейтроны - это электрически нейтральные частицы, также находящиеся в ядре атома. Количество нейтронов в ядре алюминия может варьироваться, создавая изотопы этого элемента. В природе наиболее распространенным изотопом алюминия является алюминий-27, у которого в ядре находится 14 нейтронов.
Ядро атома алюминия имеет положительный заряд, так как количество протонов превышает количество электронов. Это обуславливает химическую активность алюминия и его способность образовывать соединения с другими элементами.
Атомы алюминия созываются в металлическую решетку, где ядра находятся на местах узлов. Электроны, находящиеся внутри решетки, образуют облако электронов и связь между атомами. Благодаря своей структуре и свойствам ядра, алюминий обладает хорошей проводимостью электричества и тепла, а также высокой пластичностью и коррозионной стойкостью.
Роль атомов алюминия
Атомы алюминия играют важную роль в свойствах металла, который имеет широкое применение в различных отраслях промышленности. Алюминий является легким и прочным металлом, что обусловлено особенностями его атомного строения и связей между атомами.
Атомы алюминия обладают 13 электронами, распределенными по энергетическим уровням. Внешний энергетический уровень содержит всего один электрон, что делает атом алюминия более реакционноспособным. Именно благодаря своей активности атомы алюминия активно участвуют в химических реакциях и образуют различные соединения.
В металлической решетке атомы алюминия образуют компактную упаковку, где каждый атом окружен шестью соседними атомами, что обеспечивает прочность и упругость металла. Межатомные связи в алюминии обладают ионным и металлическим типом взаимодействия, что придает металлу его характерные электрофизические и термофизические свойства.
- Атомы алюминия обладают высокой теплопроводностью, что делает его важным материалом в производстве теплообменных устройств и радиаторов.
- Электропроводность алюминия также высока, что делает его использование возможным для создания проводов и кабелей.
- Атому алюминия присуща высокая химическая стойкость, что позволяет использовать его для изготовления контейнеров для хранения и транспортировки различных веществ.
Распространенное применение аллюминия связано с его легкостью и прочностью. В авиационной промышленности алюминий используется для создания легких и маневренных самолетов. Также алюминиевые сплавы широко применяются в производстве автомобилей и железнодорожных вагонов из-за своей прочности и антикоррозионных свойств.
Водородные связи с другими элементами

Атом алюминия обладает одним электроном в валентной оболочке, что делает его активным и способным образовывать соединения с другими элементами. Однако, водородные связи с другими элементами более сложны, так как водород имеет только один электрон и не может образовать множественные связи.
Водородные связи с атомами алюминия, например, возникают в соединениях, таких как гидроксид алюминия (Al(OH)3) и сульфат алюминия (Al2(SO4)3). В этих соединениях атомы водорода образуют связи с кислородными атомами в гидроксильных группах или сульфатных группах, а атомы алюминия образуют координационные связи с остальными атомами в соединении.
Водородные связи играют важную роль в свойствах металла алюминия. Например, они участвуют в формировании структуры алюминиевого окисла (Al2O3), которая обладает высокой термической и электроизоляционной прочностью. Кроме того, водородные связи в соединении алюминия с теллуром (Al2Te3) влияют на его полупроводниковые свойства. Водородные связи также могут быть важными в биологических системах, где они могут участвовать в формировании структуры белков и нуклеиновых кислот.
Формирование кристаллической решетки

Кристаллическая решетка алюминия формируется благодаря особенностям его атомной структуры. В основе кристаллической структуры алюминия лежит кубическая решетка, известная как "гранецентрированная кубическая решетка".
В этой решетке каждый атом алюминия окружен вокруг себя восемью ближайшими соседями, расположенными в вершинах куба и на его центральных плоскостях. Такая структура обеспечивает алюминию высокую устойчивость и прочность.
Формирование решетки происходит при охлаждении расплавленного алюминия или при его кристаллизации из паровой фазы. В процессе кристаллизации атомы алюминия устраиваются в определенном порядке, образуя регулярную упаковку. Эта упаковка обладает определенными свойствами в зависимости от взаимного расположения атомов, определяющих структуру решетки.
Кристаллическая структура алюминия является одной из причин его высокой прочности и стойкости к коррозии. Наличие решетки позволяет аллюминию образовывать микротвердые зоны и возможность деформации без разрушения структуры. Кроме того, кристаллическая структура влияет на другие свойства алюминия, такие как его электропроводность и теплопроводность.
Влияние на механические свойства металла

Строение атомов алюминия оказывает существенное влияние на его механические свойства. Алюминий обладает кубической гранецентрированной решеткой, в которой каждый атом окружен 12 соседними атомами. Такая структура обеспечивает высокую прочность на сжатие и сдвиг, но снижает его прочность на растяжение.
Однако добавление примесей в сплавы алюминия может существенно изменить его механические свойства. Например, добавление магния позволяет увеличить прочность и твердость алюминиевого сплава. Примеси также могут влиять на пластичность, устойчивость к коррозии и другие свойства металла.
Влияние на механические свойства алюминия также оказывают его микроструктура и обработка. Алюминий может быть обработан различными способами, такими как прокатка, экструзия и литье, что позволяет изменить его физические и механические свойства.
Свойства металла можно оценить с помощью различных испытаний, таких как испытания на растяжение, исследование микроструктуры и механические испытания. Эти данные позволяют определить прочность, твердость, пластичность и другие свойства алюминиевых сплавов, что важно для разработки оптимальных материалов для конкретных задач.
Вопрос-ответ

Какова структура атомов алюминия?
Структура атомов алюминия включает в себя ядро, состоящее из 13 протонов и 14 нейтронов, вокруг которого обращаются 13 электронов по энергетическим оболочкам. Внешняя оболочка содержит только 3 электрона, что делает алюминий активным металлом.
Какое место занимает алюминий в периодической таблице?
Алюминий - это химический элемент с атомным номером 13, что означает, что он занимает 13 место в периодической таблице элементов. Алюминий принадлежит к блоку p-элементов и находится в третьем периоде.
