Электронное строение атомов щелочноземельных металлов является одной из важных характеристик, определяющих их химические свойства и способности к взаимодействию с другими элементами. Щелочноземельные металлы расположены во второй группе периодической системы и включают берилий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
У атомов щелочноземельных металлов внешний энергетический уровень содержит всего один электрон. Этот электрон находится в s-подуровне, что обозначается символом "s". Формально, электронное строение этих атомов можно записать как ns1, где "n" - номер энергетического уровня (соответствующий периоду в периодической системе), а "s1" - количество s-электронов на данном уровне. Например, у атомов кальция имеется два энергетических уровня - первый и второй, и на втором уровне находится один s-электрон.
Такое электронное строение внешнего энергетического уровня обуславливает специфические свойства щелочноземельных металлов. Они характеризуются высокой химической активностью, легкостью образования ионов положительных зарядов, а также способностью к образованию и стабилизации ковалентных связей.
Интересно отметить, что электронное строение внешнего энергетического уровня щелочноземельных металлов аналогично электронному строению атома водорода - низшего элемента периодической системы. Оба этих электронных строения хорошо согласуются с принципами заполнения энергетических уровней электронами в соответствии с моделью атома Бора.
Понимание электронного строения атомов щелочноземельных металлов играет важную роль в химии и материаловедении, позволяя предсказывать и объяснять их химическую активность, свойства и взаимодействие с другими соединениями. Это знание является основой для разработки и улучшения различных технологических процессов и материалов, включая металлы, сплавы, катализаторы, электронику и многие другие области науки и промышленности.
Электронное строение атомов щелочноземельных металлов

Щелочноземельные металлы – это химическая группа в периодической системе, которая состоит из элементов типа ns1, где n означает основной энергетический уровень. Эти металлы находятся справа от щелочных металлов и имеют характерные свойства, связанные с их электронной конфигурацией.
Атомы щелочноземельных металлов имеют электронное строение с одним электроном на внешнем энергетическом уровне. Это делает их очень реакционноспособными, так как они стремятся нейтрализовать этот одиночный электрон, чтобы достичь наиболее стабильного электронного строения.
Атомный радиус щелочноземельных металлов увеличивается с увеличением периода, в то время как ионный радиус уменьшается при образовании положительных ионов.
Эти элементы образуют положительные ионы, отдавая свой один электрон. Таким образом, их удельная активность в химических реакциях увеличивается.
Из-за своей реакционности, щелочноземельные металлы широко используются в различных сферах, таких как строительство, фармацевтика, производство взрывчатых веществ и др.
Внешний энергетический уровень
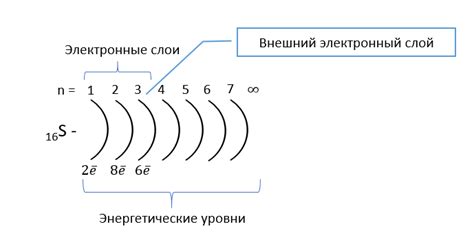
Внешний энергетический уровень в атомах щелочноземельных металлов (ns1) располагается на самой высокой энергии из всех энергетических уровней. Он содержит только один электрон, который легко удаляется из атома во время химических реакций.
Этот электрон находится в s-подуровне, который имеет форму сферы и спиновый момент 1/2. Спиновый момент определяет магнитные свойства атома. Атомы щелочноземельных металлов имеют общую характеристику - они являются хорошими проводниками тепла и электропроводности, что связано с наличием одного электрона на внешнем энергетическом уровне.
Это электронное строение обуславливает химические свойства щелочноземельных металлов, таких как реактивность и восприимчивость к окислению. Один электрон на внешнем уровне также делает эти металлы мягкими и легкоплавкими. Они имеют низкую энергию ионизации, что означает, что электрон на внешнем уровне отдаётся сравнительно легко, что обуславливает их реакционную способность.
Внешний энергетический уровень атомов щелочноземельных металлов имеет особое значение при образовании химических связей с другими атомами. Этот уровень может стать основой для образования ионов или вступать в химическую связь с атомами других элементов для образования молекул и соединений.
Электронная конфигурация ns1
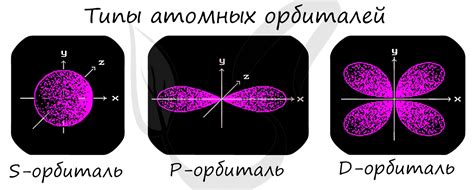
Электронная конфигурация ns1 – это особое расположение электронов на внешнем энергетическом уровне атомов щелочноземельных металлов. В электронной конфигурации ns1, символ n обозначает главный квантовый числовой уровень, а s1 – обозначает подуровень, на котором находится один электрон.
Щелочноземельные металлы – это элементы, расположенные во второй группе периодической системы, начиная с химического элемента бериллия и заканчивая радием. Эти элементы характеризуются наличием двух электронов на внешнем энергетическом уровне, который является s-подуровнем.
Благодаря электронной конфигурации ns1, щелочноземельные металлы обладают определенными свойствами. Они обладают высокой химической активностью и способностью реагировать с различными веществами. Это связано с нестабильностью электронной оболочки и желанием атома получить полностью заполненный последний энергетический уровень, избавившись от одного электрона.
Примером щелочноземельных металлов с электронной конфигурацией ns1 является, например, магний (Mg) с электронной конфигурацией 1s2 2s2 2p6 3s2. В данном случае, электронная конфигурация ns1 указывает на наличие двух электронов на внешнем энергетическом уровне 3s, что делает магний металлом с высокой химической активностью.
Щелочноземельные металлы и их свойства

Щелочноземельные металлы – это вторая группа периодической системы элементов, включающая в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они имеют характерные свойства, отличающие их от других групп элементов.
Первое внешнее энергетическое уровня атомов щелочноземельных металлов содержит одну электронную оболочку, и общая конфигурация электронов для этих элементов обозначается как ns1. Это означает, что на энергетическом уровне n имеется один электрон.
Важным свойством всех щелочноземельных металлов является их химическая реактивность. Они легко образуют связи с другими элементами, особенно с галогенами. Химическая реактивность возрастает с увеличением атомного номера, то есть от бериллия до радия.
Одно из основных свойств щелочноземельных металлов – их металлическая природа. Они обнаруживают металлоподобные свойства, такие как высокая электропроводность и температура плавления, а также блеск на поверхности. Магний и бериллий, однако, обладают некоторыми необычными свойствами, например, бериллий является неметаллом и магний несколько менее реактивен по сравнению с другими элементами группы.
Еще одно важное свойство щелочноземельных металлов – их способность образовывать ионы. Они образуют положительно заряженные ионы с 2+ зарядом, отдавая два электрона со своего внешнего энергетического уровня.
Суммируя все эти свойства, можно сказать, что щелочноземельные металлы обладают высокой химической реактивностью, металлической природой и способностью образовывать ионы. Они играют важную роль в химической промышленности, медицине и других областях нашей жизни.
Важность электронного строения в химических реакциях
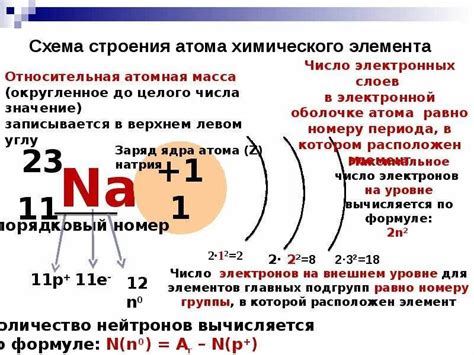
Электронное строение внешнего энергетического уровня атомов щелочноземельных металлов ns1, где n обозначает количество энергетических уровней, играет важную роль в химических реакциях. Оно определяет взаимодействие атомов с другими элементами и обуславливает их химическую активность.
Электронный конфигурация атомов щелочноземельных металлов, таких как бериллий, магний, кальций и др., характеризуется наличием одного электрона на внешнем энергетическом уровне. Эти элементы обладают высокой реакционной способностью и легко участвуют в химических реакциях, особенно в реакциях образования соединений с другими элементами.
Один свободный электрон на внешнем энергетическом уровне щелочноземельных металлов способствует их способности к образованию ионов положительного заряда. Это обуславливает их активность в реакциях с веществами, которые имеют электроотрицательные элементы или характеризуются наличием свободных электронов.
Таким образом, электронное строение внешнего энергетического уровня атомов щелочноземельных металлов ns1 играет важную роль в образовании химических соединений и определяет их свойства. Высокая реакционная способность этих элементов обусловлена наличием одного свободного электрона, который легко участвует в химических переходах и обмене электронами с другими элементами.
Вопрос-ответ

Какое электронное строение у атомов щелочноземельных металлов?
Электронное строение внешнего энергетического уровня атомов щелочноземельных металлов обозначается ns1, где n представляет собой число, обозначающее номер энергетического уровня, а s1 означает наличие одного электрона в подуровне s.
Какие элементы относятся к щелочноземельным металлам?
К щелочноземельным металлам относятся элементы второй группы периодической таблицы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Что означает ns1 в электронном строении атомов щелочноземельных металлов?
В электронном строении атомов щелочноземельных металлов ns1 означает, что на внешнем энергетическом уровне есть один электрон в s-подуровне. Например, у атома бериллия (Be) электронная конфигурация будет 1s^2 2s^2, где 2s^2 - электронная оболочка, находящаяся на внешнем энергетическом уровне.
Каково электронное строение атома магния?
Электронное строение атома магния (Mg) состоит из двух энергетических уровней. На внутреннем уровне располагается полностью заполненная 1s-оболочка, а на внешнем энергетическом уровне находится один электрон в s-подуровне. Это может быть обозначено как 1s^2 2s^1, где 2s^1 представляет один электрон, находящийся на внешнем энергетическом уровне в s-подуровне.
