Электрохимический ряд напряжений металлов – это таблица, отражающая относительную активность различных металлов в растворах электролитов. В этой таблице металлы располагаются в порядке убывания их степени активности, которая определяется их способностью отдавать электроны во время химических реакций. Электрохимический ряд является важным инструментом для определения потенциала окисления и восстановления металлов.
Основные свойства электрохимического ряда напряжений металлов заключаются в том, что металлы, расположенные выше по ряду, обладают большей активностью и способностью отдавать электроны. При контакте таких металлов с металлами, расположенными ниже, происходит окисление металла с меньшей активностью и восстановление металла с большей активностью. Это процесс, известный как гальваническая коррозия.
Электрохимический ряд напряжений металлов имеет широкое применение в различных областях, таких как электрохимия, электротехника и металлургия. Он используется для выбора пары металлов при создании гальванических элементов, а также для определения возможности реакции между различными металлами. Знание электрохимического ряда напряжений металлов позволяет ученым и инженерам эффективно проектировать и контролировать химические процессы, связанные с металлами и их соединениями.
«Электрохимический ряд напряжений металлов – это важный инструмент для определения потенциала окисления и восстановления металлов и широко применяется в научных и промышленных целях».
Что такое электрохимический ряд напряжений металлов?

Электрохимический ряд напряжений металлов — это таблица, в которой металлы располагаются в порядке убывания их электрохимической активности. Ряд показывает, как металлы взаимодействуют с растворами электролитов и друг с другом при проведении электрического тока.
В электрохимическом ряду металлы располагаются от самого активного до наименее активного. Это означает, что металлы, находящиеся выше в ряду, имеют большую способность отдавать электроны и взаимодействовать с растворами электролитов. Металлы, находящиеся ниже в ряду, имеют меньшую активность и могут выступать в роли окислителей при взаимодействии с более активными металлами или растворами электролитов.
Электрохимический ряд напряжений металлов широко используется в химических и электрохимических процессах. Например, он используется для определения направления электрохимических реакций, выбора электродов в гальванических элементах и аккумуляторах, а также для предсказания возможности и скорости реакций.
Для удобства использования, электрохимический ряд металлов обычно представляется в виде таблицы, где указаны потенциалы окисления металлов и их редукции относительно водорода. В таблице также указываются условия проведения измерений, такие как температура и концентрация электролитов, по которым были получены данные.
Таблицы электрохимического ряда напряжений металлов
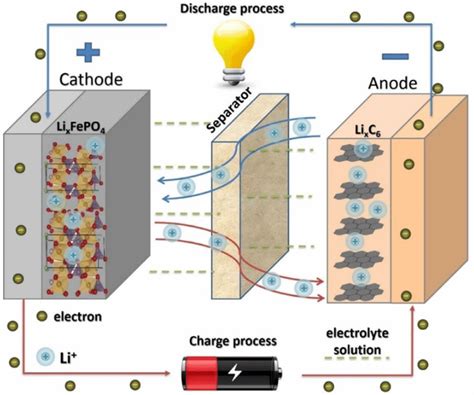
Электрохимический ряд напряжений металлов (термин также известен как ряд металлов по отношению к водороду) — это упорядоченная таблица металлов по их электрохимической активности. В таблице металлы располагаются в порядке возрастания их потенциала окисления. Потенциал окисления является показателем способности металла отдавать электроны в реакции окисления.
На верхушке электрохимического ряда находятся алкали-металлы и щелочноземельные металлы. Они обладают наибольшей активностью, поэтому они легко окисляются в присутствии воды и высвобождают водород. Внизу ряда расположены металлы с бóльшей тенденцией быть окисленными, что делает их менее активными. На самом дне ряда находятся драгоценные металлы, такие как золото и платина, которые являются наименее активными и трудно окисляемыми.
Используя таблицу электрохимического ряда напряжений металлов, можно определить, какой металл будет окислен в реакции и какой будет восстановлен. Для этого сравнивают потенциалы окисления металлов, причем более активный металл будет окислять менее активный металл.
Таблица электрохимического ряда напряжений металлов часто используется в электрохимии и гальванике для определения возможности проведения электрохимических реакций и рассчета электродных потенциалов. Она также может быть полезна в изучении коррозии металлов и процессов гальванического покрытия.
Значение электрохимического ряда напряжений металлов

Электрохимический ряд напряжений металлов является важным понятием в химической и электрохимической науках. Он представляет собой таблицу, в которой металлы упорядочены в порядке убывания их стандартных потенциалов окисления. Этот ряд позволяет определить относительные силы окислительно-восстановительных свойств различных металлов.
Значение электрохимического ряда напряжений металлов заключается в том, что он указывает, какие металлы могут действовать как окислители или восстановители в химических реакциях. Металлы, находящиеся в верхней части ряда, обладают большими потенциалами окисления и, следовательно, легко отдают электроны. Эти металлы считаются сильными окислителями.
С другой стороны, металлы, находящиеся в нижней части ряда, имеют меньшие потенциалы окисления и являются слабыми окислителями. Они, наоборот, предпочитают получать электроны и действовать как восстановители. Этот ряд также позволяет определить потенциал окисления и восстановления различных веществ и прогнозировать возможность прохождения электрокемических реакций.
Знание электрохимического ряда напряжений металлов имеет практическое значение в различных областях, включая гальванические элементы, электролиз, коррозию металлов, а также в процессах покрытия металлов с помощью электрохимических методов. Этот ряд помогает выбирать правильные сочетания металлов для создания гальванических элементов с требуемыми характеристиками.
В целом, электрохимический ряд напряжений металлов является основой для понимания и изучения электрохимических процессов и имеет большое значение в решении практических задач, связанных с использованием металлов в различных областях науки и промышленности.
Основные свойства электрохимического ряда напряжений металлов

1. Порядок расположения металлов
Электрохимический ряд напряжений металлов определяет порядок их расположения по возрастанию электрохимической активности. Чем выше металл в ряду, тем больше он способен отдавать электроны в реакциях окисления и восстановления. Это свойство определяет способность металла служить анодом или катодом в электрохимической ячейке.
2. Окислительные и восстановительные реакции
Электрохимический ряд позволяет определить, какие металлы способны окисляться (т.е. отдавать электроны) и какие металлы способны восстанавливаться (т.е. принимать электроны). Более активные металлы могут вытеснить менее активные из их соединений. Это свойство используется, например, для процессов гальванизации и гальванического покрытия металлом.
3. Коррозионная стойкость
Электрохимический ряд напряжений металлов позволяет судить о их коррозионной стойкости. Металлы, находящиеся в верхней части ряда (например, золото, платина), обладают высокой коррозионной стойкостью и не подвержены разрушению в агрессивных средах. Наоборот, металлы, находящиеся в нижней части ряда (например, железо, алюминий), имеют низкую коррозионную стойкость и быстро окисляются при контакте с влагой или кислотами.
4. Межметаллические связи
Электрохимический ряд напряжений металлов позволяет предсказывать возможность образования межметаллических соединений. Если два металла находятся на разных концах ряда, то они создают электрохимическую пару с большой разностью потенциалов, что способствует образованию коррозии и возможному разрушению. Поэтому, при выборе материалов для конструкции, необходимо учитывать их взаимное положение в электрохимическом ряду.
5. Электродный потенциал
Электрохимический ряд напряжений металлов позволяет определить электродный потенциал каждого металла, то есть разность электрического потенциала между металлом и стандартным водородным электродом. Это свойство важно при изучении электрохимических процессов и определении направления протекания реакций.
6. Электрохимическая активность
Электрохимический ряд напряжений металлов позволяет сравнивать их электрохимическую активность. Более активные металлы могут отдавать электроны более легко и быстро, а значит, способны проявлять большую "химическую активность" в реакциях с другими веществами. Это свойство регулирует электрохимические процессы, такие как электролиз, гальваническая коррозия и аккумуляция энергии в электрохимических аккумуляторах.
Влияние электрохимического ряда напряжений металлов на коррозию

Электрохимический ряд напряжений металлов является важным инструментом для определения вероятности возникновения коррозии. Он отражает относительную склонность металлов к окислительным и восстановительным реакциям, что позволяет предсказывать и контролировать процессы, связанные с коррозией различных металлов.
По электрохимическому ряду можно определить, какой металл будет корродировать, если он находится в контакте с другим металлом в присутствии электролита. Металлы, находящиеся выше в ряду, будут восстанавливаться, а ниже - окисляться. Это объясняет, почему при использовании разных металлов в конструкции могут возникать проблемы с коррозией.
Коррозия происходит в результате гальванической пары, образующейся между анодом (металл, окисляющийся) и катодом (металл, восстанавливающийся). Чем больше разница в потенциалах между этими металлами, тем быстрее происходит процесс коррозии. Поэтому при выборе металлов для конструкций или контактных поверхностей необходимо учитывать их положение в электрохимическом ряду.
Дополнительные факторы, такие как наличие влаги, кислорода и других агрессивных сред, также оказывают влияние на коррозию. Но электрохимический ряд металлов является определяющим фактором, поскольку он отражает их внутреннюю электрохимическую активность. Это позволяет инженерам и конструкторам выбирать металлы, наиболее устойчивые к коррозии, и применять различные методы защиты от коррозии.
Практическое использование электрохимического ряда напряжений металлов

Электрохимический ряд напряжений металлов является важным инструментом в химических и электрохимических процессах. Он позволяет определить потенциал окисления или восстановления металла и его способность участвовать в различных реакциях.
Одним из практических применений электрохимического ряда является выбор материала для создания защитных покрытий. Зная положение металла в ряду, можно выбрать материал, который будет служить анодом и защитить основной металл от коррозии.
Электрохимический ряд также используется для определения направления потока электронов в гальванических элементах. При наличии двух различных металлов и электролита, потенциал более активного металла будет ниже, а потенциал менее активного металла будет выше. Таким образом, возникает разность потенциалов, что приводит к току электронов через внешнюю нагрузку.
Другим полезным применением электрохимического ряда является определение возможности проведения электролиза. Единственные металлы, которые могут быть восстановлены из растворов ионов своего металла, находятся выше в ряду. Из этого следует, что приложение напряжения к электролиту, содержащему ионы металла, позволит провести электролиз и извлечь металл из раствора.
Электрохимический ряд напряжений металлов в живых организмах

Электрохимический ряд напряжений металлов определяет их способность участвовать в химических реакциях в живых организмах, в том числе в процессе окислительно-восстановительных реакций. Каждый металл имеет определенное напряжение, которое указывает на то, насколько легко он отдает или принимает электроны в реакциях.
В живых организмах встречаются различные металлы, которые играют важную роль в регуляции процессов обмена веществ. Например, железо является необходимым компонентом гемоглобина, который отвечает за транспорт кислорода в организме. Ртуть выполняет функцию катализатора в реакциях, регулирующих передачу нервных импульсов.
На основе электрохимического ряда можно определить, какой металл будет приоритетно окисляться или восстанавливаться в данной реакции. Металлы, находящиеся выше в ряду, имеют большее напряжение и будут отдавать электроны металлам, находящимся ниже. Это позволяет участвующим металлам выполнять свои функции в организме и поддерживать его нормальное функционирование.
Электрохимический ряд напряжений металлов также используется для прогнозирования возможных эффектов контакта различных металлов с тканями организма. Некоторые металлы, такие как свинец или ртуть, могут иметь токсическое действие на организм, поэтому важно быть осторожным при использовании изделий, содержащих эти металлы, особенно внутри организма.
Исследования и разработки в области электрохимического ряда напряжений металлов

Электрохимический ряд напряжений металлов представляет собой важный инструмент в химии и электрохимии, используемый для определения и сравнения активности различных металлов в различных химических реакциях. В исследованиях и разработках в области электрохимического ряда напряжений металлов активно изучаются свойства и поведение металлов при взаимодействии с различными реагентами и электролитами.
Одной из основных целей исследований является определение порядка активности металлов в электрохимических процессах, а также оценка их способности к окислению или восстановлению. Развитие новых материалов и технологий, основанных на электрохимическом ряде напряжений, также является важным направлением исследований.
Исследования в области электрохимического ряда напряжений металлов проводятся как в лабораторных условиях, так и в промышленности. На основе полученных данных производятся выбор материалов для различных электрохимических процессов, таких как электролиз, гальваническая оцинковка, а также для создания эффективных элементов питания, батарей и аккумуляторов.
Исследования и разработки в области электрохимического ряда напряжений металлов играют важную роль в современной науке и технологии. Они позволяют не только лучше понять физико-химические свойства металлов, но и создавать новые материалы и улучшать существующие технологии с использованием электрохимических принципов и процессов.
Вопрос-ответ

Что такое электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов - это таблица, в которой металлы упорядочены по убыванию их стандартных окислительно-восстановительных потенциалов. Этот ряд определяет относительные значения потенциалов различных металлов в специфических электрохимических реакциях.
Каково значение электрохимического ряда напряжений металлов для различных процессов?
Электрохимический ряд напряжений металлов играет важную роль при описании и предсказании реакций окисления и восстановления в различных системах. С его помощью можно определить, какие металлы будут окисляться, а какие восстанавливаться при электрохимических процессах, таких как гальванические элементы, аккумуляторы и коррозия металлов.