Щелочноземельные металлы - это группа химических элементов, которые находятся во второй группе периодической системы. Они включают в себя бериллий, магний, кальций, стронций, барий и радий. Эти металлы обладают рядом уникальных свойств и широко используются в различных областях.
Одно из самых известных свойств щелочноземельных металлов - это их способность реагировать с водой. При контакте с водой они образуют гидроксиды, выделяя при этом водород. Например, реакция кальция с водой приводит к образованию кальция гидроксида и выделению водорода. Это свойство позволяет использовать щелочноземельные металлы в процессе образования водорода, который может быть использован в качестве источника энергии.
Интересный факт: Барий является одним из самых тяжелых щелочноземельных металлов и используется в медицине как контрастное вещество для рентгеновских исследований.
Другое важное свойство щелочноземельных металлов - это их способность образовывать соли. Соли, полученные из щелочноземельных металлов, широко используются в различных отраслях, таких как строительство, сельское хозяйство и фармацевтика. Например, кальций используется для производства цемента и минеральных удобрений, а бериллий применяется в производстве сплавов с высокой прочностью.
Кроме того, щелочноземельные металлы имеют особые свойства, которые делают их полезными в электронике и оптике. Например, стронций используется для производства светоизлучающих диодов, которые широко используются в дисплеях и освещении. Магний обладает высокой электропроводностью и выдерживает высокие температуры, поэтому его сплавы используются в аэрокосмической и автомобильной промышленности.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы – это группа элементов, состоящая из бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra). Они относятся к основным металлам, поскольку имеют высокую электропроводность, химическую активность и низкую температуру плавления.
Первая особенность, характеризующая щелочноземельные металлы, – их тенденция к образованию двухвалентных катионов. Они имеют два электрона на внешнем энергетическом уровне, из которых они легко отдают один электрон, чтобы достичь стабильной электронной конфигурации. Это делает их хорошими агентами «донорами» электронов и способствует образованию соединений с атомами других элементов.
Кроме того, щелочноземельные металлы имеют высокую активность в реакциях с водой. При контакте с водой они реагируют, выделяя водород и образуя щелочные гидроксиды. Например, магний реагирует с водой, образуя гидроксид магния (Mg(OH)2) и выделяя газообразный водород (H2). Этот процесс используется для получения водорода в промышленности и в лабораторных условиях.
Другой важной особенностью щелочноземельных металлов является их низкая реактивность с кислородом. Они образуют оксиды, которые обладают щелочными свойствами. Например, оксид кальция (CaO) образует щелочную реакцию с водой, образуя гидроксид кальция (Ca(OH)2). Это имеет практическое значение в процессах гашения извести и получения цемента.
Также щелочноземельные металлы обладают способностью образовывать соли, которые имеют широкое применение. Например, сульфаты кальция, бария и стронция используются в медицинской технике для рентгенологических исследований, а гидроксид бария (Ba(OH)2) применяется в стекольной промышленности.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы - это группа химических элементов, включающих бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они отличаются рядом интересных физических свойств, которые делают их уникальными и полезными в различных областях жизни.
Плотность: Щелочноземельные металлы обладают низкой плотностью, что делает их легкими и прочными материалами. Например, магний имеет плотность всего 1,74 г/см³, что делает его одним из самых легких металлов.
Температура плавления и кипения: У щелочноземельных металлов относительно низкая температура плавления и кипения. Например, плавление магния происходит при 650°C, а кипение при 1090°C. Это позволяет использовать эти металлы в различных промышленных процессах, в том числе в производстве сплавов с другими металлами.
Проводимость электричества: Щелочноземельные металлы обладают хорошей электрической проводимостью. Это связано с наличием свободных электронов в их внешней электронной оболочке. Благодаря этому свойству они широко используются в электротехнике и электронике для создания проводников и электрических контактов.
Магнитные свойства: Часть щелочноземельных металлов, таких как стронций и барий, обладает магнитными свойствами. Они способны притягиваться к магниту и сохранять магнитное поле после воздействия внешнего магнитного поля. Это делает их полезными материалами в производстве магнитов и магнитных устройств.
В таблице ниже представлено сравнение физических свойств щелочноземельных металлов:
| Металл | Плотность (г/см³) | Температура плавления (°C) | Температура кипения (°C) |
|---|---|---|---|
| Бериллий | 1,85 | 1287 | 2469 |
| Магний | 1,74 | 650 | 1090 |
| Кальций | 1,55 | 842 | 1484 |
| Стронций | 2,63 | 769 | 1382 |
| Барий | 3,62 | 727 | 1870 |
| Радий | 5,5 | 700 | 1737 |
Знание физических свойств щелочноземельных металлов играет важную роль в развитии науки и технологий, а также в их применении в различных областях жизни.
Применение щелочноземельных металлов в различных областях

Щелочноземельные металлы, такие как магний, кальций, стронций и барий, нашли широкое применение в различных областях нашей жизни. Они обладают уникальными свойствами, которые делают их полезными в различных индустриальных и научных процессах.
Один из популярных способов использования щелочноземельных металлов - их добавление в сплавы для улучшения механических свойств и стойкости к коррозии. Например, магний добавляется в алюминиевые сплавы, чтобы сделать их легче и прочнее. Кальций используется в процессе производства стали, чтобы уменьшить содержание кислорода и других примесей.
Щелочноземельные металлы также находят применение в производстве электродов для сварки, так как они обладают хорошей проводимостью электричества и высоким температурным сопротивлением. Ключевую роль играет магний, который является одним из основных компонентов в производстве магниевых электродов.
Еще одна область применения щелочноземельных металлов - производство горючих веществ. Например, стронций используется в производстве пиротехнических материалов, таких как фейерверки, благодаря способности металла изменять цвет пламени. Барий находит применение в производстве рентгеновских контрастных средств, которые позволяют улучшить видимость органов при медицинских обследованиях.
Щелочноземельные металлы играют также важную роль в сельском хозяйстве. Кальций используется в качестве добавки в почву для улучшения ее структуры и регулирования уровня pH. Магний является необходимым элементом для здорового роста растений, а кальций и стронций применяются в производстве удобрений.
В целом, щелочноземельные металлы находят широкое применение в различных отраслях, начиная от металлургии и химической промышленности до медицины и сельского хозяйства. Их уникальные свойства делают их ценными материалами для разных процессов и продуктов, которые используются в нашей повседневной жизни.
Взаимодействие щелочноземельных металлов с другими элементами
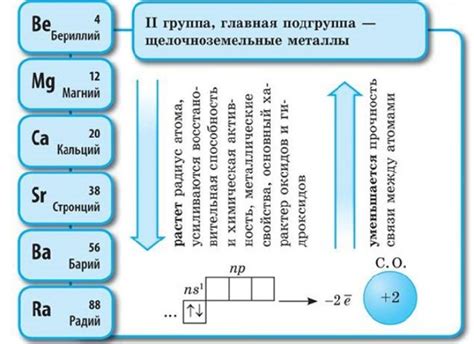
Щелочноземельные металлы - это группа элементов, состоящая из шести химических элементов: бериллия, магния, кальция, стронция, бария и радия. У них очень интересные свойства, включая взаимодействие с другими элементами.
Первым щелочноземельным металлом является бериллий. Он имеет высокую степень реакционности, особенно при температурах выше 600 градусов Цельсия. Бериллий способен вступать в реакцию с кислородом, образуя оксид бериллия (BeO). Этот оксид является важным компонентом в производстве керамики и других материалов.
Магний, второй по порядку щелочноземельный металл, также обладает высокой степенью реакционности. Он способен образовывать соединения с кислородом, серой и азотом. Например, магний реагирует с кислородом, образуя оксид магния (MgO). Этот оксид является основной составляющей материалов, используемых в строительстве и промышленности.
Кальций, третий по порядку щелочноземельный металл, также проявляет активность во взаимодействии с другими элементами. Он способен реагировать с кислородом, образуя оксид кальция (CaO). Этот оксид широко используется в производстве цемента и стекла.
Стронций, барий и радий также способны реагировать с кислородом и другими элементами. Например, стронций образует оксид стронция (SrO), который используется в производстве фарфора и керамики.
Таким образом, взаимодействие щелочноземельных металлов с другими элементами имеет большое значение в различных отраслях промышленности и науки.
Вопрос-ответ

Какие металлы относятся к щелочноземельным?
К щелочноземельным металлам относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какие свойства щелочноземельных металлов делают их уникальными?
Щелочноземельные металлы обладают рядом уникальных свойств, например, они легкозапекаемы, довольно мягкие и реактивные. Они также обладают высокой теплопроводностью, проводимостью электричества и образуют оксиды, которые обладают щелочными свойствами. Кроме того, щелочноземельные металлы имеют низкую плотность, что часто делает их полезными в различных промышленных процессах.
