Взаимодействие металла и электролита является сложным процессом, который результатом своего действия может иметь разрушение металла. Этот процесс носит название "коррозия", и он является одной из основных причин разрушения металлических конструкций и поверхностей.
Основная причина разъедания металла электролитом заключается в процессах окисления и редукции, которые происходят на поверхности металла. Электролит - это раствор, содержащий положительно и отрицательно заряженные ионы, которые способны проводить электрический ток. Металл же является проводником электричества.
При контакте металла с электролитом, происходит перенос электронов с поверхности металла на ионы электролита. Этот процесс называется окислением металла и соответствующей реакцией редукции электролита. В результате окисления металла образуются ионы металла, которые растворяются в электролите, а на его поверхности образуется окисная пленка или ржавчина.
В процессе взаимодействия металла и электролита очень важными факторами являются pH значения электролита и концентрация его ионов. Например, для некоторых металлов низкое pH значение электролита может ускорять процесс разъедания, так как кислотные условия могут способствовать образованию коррозионной активной зоны. Кроме того, на скорость коррозии может влиять и концентрация ионов электролита, так как большое количество ионов может усилить реакцию окисления металла.
Таким образом, взаимодействие металла и электролита представляет сложные электрохимические процессы, которые приводят к окислению металла и его разъеданию. Учет pH значения и концентрации ионов электролита важен для понимания и контроля этого процесса. Поэтому при проектировании металлических конструкций и выборе материалов необходимо учитывать их коррозионную стойкость и выбирать электролиты, которые будут максимально безопасны для металла.
Как металлы реагируют на взаимодействие с электролитами
Взаимодействие металлов и электролитов является основополагающим процессом в химии и электрохимии. При этом происходит электрохимическая реакция, которая может приводить к различным последствиям для металла.
В зависимости от типа электролита и условий взаимодействия, металл может растворяться в электролите, образовывать оксидные пленки или подвергаться коррозии. Реакция металлов с электролитами основана на передаче электронов от металла к ионам в электролите.
Металлы, такие как алюминий и цинк, могут растворяться в кислотных электролитах. При этом они переходят в ионы, которые диссоциируются в электролите. Это явление называется анизотропной диссоциацией. Растворение металла может привести к образованию газа и изменению концентрации электролита. Для защиты таких металлов от растворения обычно применяют покрытия из защитных материалов, таких как полимеры или оксиды.
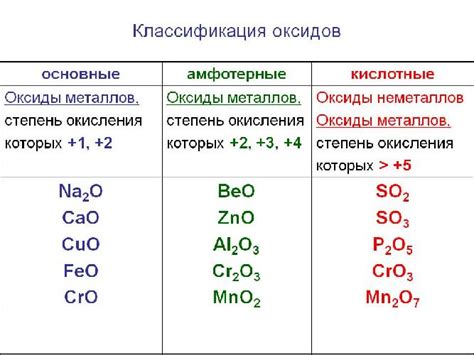
Некоторые металлы, включая железо и сталь, образуют оксидные пленки при взаимодействии с кислородсодержащими электролитами. Данная реакция может протекать при обычных условиях и называется пассивацией металла. Образование пленки защищает металл от дальнейшей коррозии.
Однако, некоторые металлы, такие как железо и алюминий, подвержены коррозии в нейтральных или щелочных электролитах. В результате взаимодействия металла с электролитом происходит окислительно-восстановительная реакция, в которой металл окисляется и теряет свои положительные свойства. Коррозия металла может приводить к его разрушению и негативно влиять на работу различных устройств и конструкций.
Таким образом, взаимодействие металлов с электролитами может приводить к различным результатам, включая растворение металла, образование оксидных пленок и коррозию. Понимание этих процессов позволяет разрабатывать методы защиты от коррозии и оптимизировать использование металлов в различных областях науки и промышленности.
Отождествление вида электролита и его влияние на реакцию с металлом

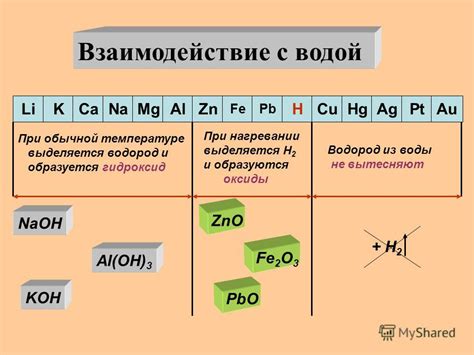
Взаимодействие металла и электролита определяется видом электролита, который может быть кислотным, щелочным или солевым. Каждый из этих типов электролитов влияет на реакцию с металлом по-разному.
Кислотные электролиты, как например соляная кислота (HCl), способны разъедать металлы путем выделения водорода при контакте с поверхностью металла. Молекулы кислоты реагируют с металлом, образуя соль и водород. Кислотные электролиты могут разъесть металл исключительно в условиях активной коррозии при наличии воды и кислорода.
Щелочные электролиты, такие как гидроксид натрия (NaOH), действуют на поверхность металла окислением его и образованием гидроксида металла. Взаимодействие происходит без выделения водорода, и металл получает защитный оксидный слой. Однако, если процесс щелочной коррозии протекает достаточно активно, тогда металл может разрушаться.
Солевые электролиты, такие как хлорид натрия (NaCl), вызывают коррозию металла путем образования на его поверхности окалины. В процессе коррозии солевым электролитом, на поверхности металла образуется концентрированное растворение хлорида металла, что может привести к дальнейшему разрушению металла.
Как формируются электролитические ячейки и как это связано с разъеданием металла
Взаимодействие металла с электролитом может происходить в условиях электролитической ячейки. Электролитическая ячейка состоит из двух электродов - анода и катода, которые находятся в контакте с электролитом. Анод представляет собой металл, который будет разъедаться, а катод - часть электролита или другой металл, не подлежащий разъеданию.
Процесс разъедания металла в электролите связан с протеканием электрохимической реакции. В электролите находятся положительно и отрицательно заряженные ионы. При подключении внешнего источника тока к электродам ячейки, происходит движение электронов от анода к катоду через электролит. Это приводит к окислению металла анода, который превращается в ионы в электролите.
Разъедание металла в электролите происходит из-за дисбаланса реакций окисления и восстановления на поверхности металла. Анод представляет собой зону окисления, где происходит окисление металла и образование ионов, которые растворяются в электролите. Катод, в свою очередь, представляет собой зону восстановления, где ионы из электролита получают электроны и осаждаются на поверхности металла.
Таким образом, формирование электролитической ячейки и протекание электрохимической реакции на поверхности металла связаны с разъеданием металла. Именно благодаря протеканию электрохимической реакции и образованию ионов в электролите происходит разрушение металлической поверхности. Понимание этих процессов позволяет контролировать разъедание металла и разрабатывать методы защиты от коррозии.
Процесс окисления-восстановления во взаимодействии металла и электролита
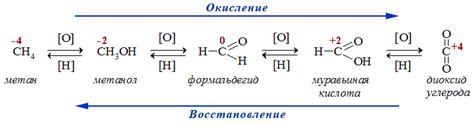
Взаимодействие металла и электролита обусловлено процессом окисления-восстановления, при котором происходит перенос электронов между металлом и электролитом. Этот процесс основан на способности металла отдавать или принимать электроны в реакции с ионами электролита.
Когда металл контактирует с электролитом, происходит разделение водорода на ионы водорода и ионы гидроксида. Если металл обладает более высокой электрохимической активностью, то он отдаёт электроны и переходит в ионное состояние, образуя положительный ион. Электроны, отданные металлом, передаются к ионам водорода, которые принимают электроны и образуют нейтральные молекулы водорода.
В случае, если металл менее активен, он принимает электроны, превращаясь в ион с отрицательным зарядом. Ионы гидроксида в этом случае переходят в нейтральное состояние и образуют молекулы воды. Это происходит благодаря передаче электронов от отрицательно заряженного иона гидроксида к металлу.
Весь процесс окисления-восстановления во взаимодействии металла и электролита осуществляется по принципу сопоставления электрохимических потенциалов между различными металлами и ионами электролита. Разная электрохимическая активность металлов и разные значения их стандартных потенциалов определяют направление потока электронов и, следовательно, характер взаимодействия между металлом и электролитом.
Роль электролита в контроле скорости коррозии металла

Электролит играет важную роль в процессе коррозии металла, являясь неотъемлемым компонентом этого процесса. Он обеспечивает возможность передачи электронов между металлом и окружающей средой, что позволяет инициировать и поддерживать химические реакции, приводящие к разрушению металлической структуры.
Одним из главных электролитов, взаимодействующих с металлами, является вода. В присутствии воды металлы могут претерпевать окислительно-восстановительные реакции, при которых происходит потеря электронов и образование ионов. Передача электронов от металла к воде происходит через реакции окисления и восстановления, которые катализируются растворенными в воде веществами.
Реакции коррозии металлов происходят с различной скоростью, и электролит играет важную роль в контроле этой скорости. Некоторые электролиты способствуют активизации реакций коррозии, ускоряя их протекание, в то время как другие электролиты могут замедлять процесс разрушения металла. Это связано с тем, что различные электролиты обладают различными свойствами, которые влияют на процессы окисления и восстановления.
Например, в кислых растворах, электролиты с высокой кислотностью могут усиливать скорость коррозии металлов, поскольку они обладают окислительными свойствами. Наоборот, в щелочных растворах, электролиты с высоким pH могут замедлять коррозию, поскольку они обладают восстановительными свойствами.
Таким образом, электролит играет важную роль в контроле скорости коррозии металла. Понимание свойств электролитов и их влияния на процессы окисления и восстановления металла позволяет разрабатывать эффективные методы защиты от коррозии и увеличивать срок службы металлических конструкций.
Факторы, влияющие на выбор электролита для конкретного типа металла
При выборе электролита для взаимодействия с определенным типом металла необходимо учитывать несколько факторов.
1. Химические свойства металла: Разные металлы реагируют с электролитом по-разному, поэтому важно учесть его химические свойства при выборе электролита. Некоторые металлы могут быть стабильными в определенных условиях, но могут коррозировать или даже растворяться при взаимодействии с определенными электролитами.
2. Тип коррозии металла: Различные электролиты могут быть эффективны при разных типах коррозии. Например, для поверхностной коррозии может потребоваться использование электролита с высокой концентрацией солей, а для напряженной коррозии – электролита с низким уровнем кислотности.
3. Температурные условия: Температура также является важным фактором при выборе электролита для конкретного металла. Некоторые электролиты могут быть эффективны при высоких температурах, в то время как другие могут стать менее эффективными или даже стать агрессивными при повышенных температурах.
4. Экологические и экономические аспекты: Выбор электролита также следует основывать на его экологических и экономических характеристиках. Важно выбирать электролит, который обладает минимальными негативными воздействиями на окружающую среду и имеет доступную цену.
Таким образом, при выборе электролита для конкретного типа металла необходимо учитывать его химические свойства, тип коррозии, температурные условия, а также экологические и экономические аспекты.
Методы защиты металла от разъедания электролитом

Взаимодействие металла с электролитом может привести к его разъеданию и к значительным потерям материала и ресурса. Для защиты металла от разъедания существуют различные методы и технологии, которые позволяют увеличить его срок службы и обеспечить его стабильное функционирование.
Один из основных методов защиты металла от разъедания - это применение защитных покрытий. Покрытия создаются из различных материалов, таких как краски, лаки, эмали и пластиковые пленки. Они образуют на поверхности металла защитный слой, который препятствует проникновению электролита и предотвращает контакт металла с агрессивными веществами. Такие покрытия могут быть нанесены как непосредственно на металл, так и в виде специальных защитных покрытий на поверхности.
Другим методом защиты металла от разъедания является использование анодной защиты. Анодная защита основана на принципе электролиза и заключается в том, чтобы создать электрический ток, который направляется на поверхность металла. Это позволяет создать защитный слой на металле, который предотвращает его разрушение под влиянием электролита.
Кроме того, существуют такие методы защиты металла от разъедания электролитом, как использование коррозионностойких материалов, изменение pH значения электролита, использование ингибиторов коррозии, механическая защита и многие другие. Каждый из этих методов имеет свои особенности и применяется в зависимости от конкретных условий эксплуатации и требований к металлу.
Особенности разъедания цветных металлов различными электролитами

Разъедание цветных металлов электролитами является важным процессом в промышленности и научных исследованиях. Различные электролиты могут иметь разную эффективность и особенности в разъедании цветных металлов.
Одним из наиболее распространенных электролитов, используемых для разъедания цветных металлов, является серная кислота (H2SO4). Этот электролит обладает высокой агрессивностью и может разъедать медь, свинец и никель. При этом, разъедание происходит при высокой скорости, что делает серную кислоту эффективным электролитом для данного процесса.
Другим распространенным электролитом, применяемым для разъедания цветных металлов, является хлористоводородная кислота (HCl). Она активно взаимодействует с алюминием и титаном, разъедая их при высокой скорости. Однако, она имеет сравнительно низкую агрессивность по отношению к другим цветным металлам, таким как медь или свинец.
Кроме того, для разъедания цветных металлов также используются комплексные электролиты, содержащие большое количество органических кислот и солей. Такие электролиты обладают особенностями в разъедании различных цветных металлов и могут быть более эффективными по сравнению с обычными кислотами.
Итак, разъедание цветных металлов различными электролитами зависит от их состава, агрессивности и концентрации. Каждый электролит имеет свою эффективность и особенности в разъедании определенных металлов, поэтому выбор правильного электролита имеет важное значение для успешного проведения процесса разъедания.+
Применение взаимодействия металла и электролита в промышленных процессах

Взаимодействие металла и электролита имеет широкое применение в промышленных процессах. Одним из таких процессов является гальваническое покрытие, которое применяется для нанесения защитных и декоративных покрытий на металлические изделия. В данном процессе металлический предмет погружается в электролит, в котором содержатся растворенные соли металла, образуя так называемую гальваническую ячейку.
Применение гальванического покрытия позволяет защитить металл от коррозии, а также придать ему желаемые декоративные свойства, например, создать зеркальное или золотистое покрытие. Это особенно важно в промышленности, где металлические изделия часто подвержены воздействию влаги, кислот и щелочей.
В процессе гальванического покрытия металл является анодом, а катодом выступают предметы, на которые наносится покрытие. Путем подачи электрического тока через электролит осуществляется перенос растворенных ионов металла на поверхность катода, где они осаждается в виде покрытия.
Кроме гальванического покрытия, взаимодействие металла и электролита применяется в других промышленных процессах, таких как электролиз, электрохимическая очистка и травление металла. Знание и контроль данных процессов позволяют получать высококачественные металлические изделия с требуемыми свойствами.
Вопрос-ответ

Почему металл растворяется в электролите?
Металл растворяется в электролите из-за электрохимической реакции между металлом и электролитом. Когда металл погружается в электролит, происходит перемещение электронов из металла в электролит. Как только электроны покидают металл, образуется положительно заряженный ион металла, который переходит в электролит. Этот процесс называется окислением металла и ионизацией. В то же время, в электролите образуется отрицательно заряженный ион, который перемещается к металлу и участвует в реакции растворения. Таким образом, растворение металла в электролите происходит благодаря переносу электронов и ионов между металлом и электролитом.
Какие факторы влияют на скорость растворения металла в электролите?
Скорость растворения металла в электролите зависит от нескольких факторов. Важными факторами являются концентрация электролита, температура, площадь поверхности металла и тип электролита. Высокая концентрация электролита и повышенная температура способствуют ускоренному растворению металла. Большая площадь поверхности металла также увеличивает скорость растворения, поскольку больше места для реакции между металлом и электролитом. Тип электролита также может влиять на скорость растворения металла, так как некоторые электролиты более активны и способствуют более быстрой реакции.
Какие металлы легче всего растворяются в электролите?
Некоторые металлы легче всего растворяются в электролите. Например, металлы, такие как цинк, железо и алюминий, быстро растворяются в кислотных электролитах, таких как серная кислота или соляная кислота. Это связано с тем, что эти металлы являются более активными в отношении электролита и имеют большую склонность к окислению. Другие металлы, такие как золото и платина, менее склонны к растворению в электролите и могут быть устойчивы к воздействию большинства электролитов.
