Электрохимический ряд напряжений металлов – это таблица, которая отражает активность металлов в электрохимических реакциях. Он составляется на основе напряжений окисления или восстановления металлов и используется для определения того, какой металл может вытеснить другой из его солей или растворов. Электрохимический ряд напряжений металлов является полезным инструментом для понимания электрохимических процессов и определения их возможности.
В электрохимическом ряде металлы располагаются в порядке убывания их активности. Это означает, что металл с большей активностью (большими положительными значениями напряжений окисления или малыми отрицательными значениями напряжений восстановления) может вытеснить металл с меньшей активностью из его соединений и вступить в реакцию с ними. Например, металл с большей активностью в ряду может вытеснить металл с меньшей активностью из его соли или раствора.
Использование электрохимического ряда напряжений металлов позволяет предсказывать результаты электрохимических реакций. Если два металла присутствуют в одном растворе или соли, то металл с более низким значением напряжения окисления (или более высоким значениям напряжения восстановления) будет вытеснен металлом с более высоким значением напряжения окисления (или более низким значениям напряжения восстановления).
Понятие и принципы электрохимического ряда напряжений металлов

Электрохимический ряд напряжений металлов – это упорядоченный список металлов, отсортированный по их активности во взаимодействии с ионами водорода. Ряд позволяет определить реакционную способность различных металлов при контакте с растворами электролитов.
Принцип работы электрохимического ряда основан на том, что более активные металлы имеют больший потенциал окисления и, следовательно, легче отдают электроны, чтобы превратиться в ионы в растворе. Металлы располагаются в ряду в порядке возрастания их потенциала окисления.
На основе электрохимического ряда можно предсказать реакционную способность металлов при контакте с другими веществами. Если металл находится выше в ряду, чем другой металл, он будет активнее и способен вытеснить его из раствора ионов или соединений. Например, цинк (Zn) имеет более высокую активность, чем медь (Cu), поэтому при погружении цинка в раствор сульфата меди (CuSO4), цинк будет вытеснять медь и образовывать сульфат цинка (ZnSO4).
Электрохимический ряд напряжений металлов является важным инструментом в электрохимии и находит свое применение в различных областях, таких как гальванические элементы, аккумуляторы, электролиз, коррозия металлов и другие.
Важность активности металлов в электрохимии

Активность металлов в электрохимических реакциях является важным понятием, определяющим их способность вступать в химические реакции с другими веществами. Электрохимический ряд напряжений металлов позволяет определить относительную активность различных металлов относительно друг друга.
Активность металлов влияет на их способность окисляться или восстанавливаться в реакциях электролиза. В электрохимических процессах, металлы, обладающие более высокой активностью, будут вытеснять металлы с более низкой активностью из ионного раствора. Например, когда медь (Cu) и цинк (Zn) погружаются в раствор серной кислоты (H₂SO₄), цинк будет активно реагировать, вытесняя ион меди и образуя ионы цинка. Электрохимический ряд напряжений позволяет предсказать, какие металлы будут активнее и, следовательно, осуществят вытеснение.
Знание активности металлов также позволяет определить направление электродных процессов в гальванических элементах. Путем сравнения активностей двух полуэлементов можно сказать, какой металл будет окисляться (катод) и какой будет восстанавливаться (анод). Это важно для производства электрической энергии в различных устройствах, таких как батарейки и аккумуляторы.
В общем, электрохимический ряд напряжений металлов является инструментом, позволяющим определить активность металлов и их способность вступать в реакции электролиза. Знание активности металлов полезно для прогнозирования и понимания электрохимических процессов и может быть использовано в различных областях, таких как производство энергии и химической промышленности.
Практическое применение электрохимического ряда напряжений

Электрохимический ряд напряжений металлов является важным инструментом в области электрохимии и находит широкое практическое применение. Зная положение металла в ряду, можно предсказать его активность и его способность взаимодействовать с другими веществами.
Электрохимический ряд напряжений используется, например, для определения того, какой металл будет растворяться при контакте с раствором соли другого металла. Более активный металл будет вытеснять менее активный металл из его соединения и образовывать раствор. Этот принцип используется, например, при оценке коррозионной стойкости различных металлических материалов и при выборе правильной комбинации материалов в различных конструкциях и устройствах.
Электрохимический ряд напряжений также находит применение в процессе гальванического покрытия металлических поверхностей. Зная, какой металл является более активным, можно управлять направлением электронного потока и контролировать образование покрытия на поверхности из более активного металла. Это позволяет предотвратить коррозию и улучшить внешний вид и эстетические характеристики изделия.
Кроме того, электрохимический ряд напряжений используется при разработке и оптимизации электрохимических элементов, таких как аккумуляторы и гальванические элементы. Зная напряжение электродных пар, можно предсказать и улучшить энергетическую эффективность и производительность этих устройств.
Таким образом, электрохимический ряд напряжений является важным инструментом, который позволяет предсказывать и контролировать электрохимические процессы и применять их в различных сферах науки и техники.
Выбор основного металла в электрохимических процессах

Основной металл, выбранный для проведения электрохимических процессов, играет важную роль в определении их эффективности и экономичности. При выборе металла рекомендуется учитывать его положение в электрохимическом ряду напряжений. Электрохимический ряд напряжений металлов позволяет оценить активность металла в отношении электронов.
Наиболее активные металлы в электрохимическом ряду напряжений располагаются в верхней его части, что означает их большую склонность отдавать электроны. Они хорошо использоваться в качестве анода в электрохимических процессах, таких как электролиз и оцинкование. Примеры таких металлов – цинк, алюминий, магний.
Более низкие металлы в электрохимическом ряду предпочтительно используют в качестве катода. На катоде металл получает электроны и претерпевает окисление, защищая тем самым анодные металлы. К таким металлам относятся железо, медь, никель.
Однако выбор основного металла в электрохимических процессах не ограничивается только положением металла в электрохимическом ряду. Еще одним важным фактором является его химическая стойкость и коррозионная стабильность. Причем стойкость металла зависит не только от его активности, но и от условий работы и состава электролита.
Таким образом, при выборе основного металла в электрохимических процессах необходимо учитывать его положение в электрохимическом ряду напряжений, а также его химическую стойкость и применимость для конкретной задачи. Обратите внимание на комплексный подход при выборе металла, чтобы обеспечить эффективный и долговечный проведение электрохимических процессов.
Реакции окислительно-восстановительного процесса с участием металлов

Окислительно-восстановительные процессы с участием металлов являются важным аспектом в химии и электрохимии. Металлы могут проявлять активность в реакции окисления или восстановления в зависимости от их положения в электрохимическом ряду напряжений металлов.
Электрохимический ряд напряжений металлов представляет собой таблицу, в которой металлы располагаются по возрастанию их активности. Верхние металлы в ряду, такие как литий и калий, являются наиболее активными и имеют большую способность к окислению. Нижние металлы, такие как золото и платина, наоборот, являются наименее активными и обладают большей способностью к восстановлению. Эти различия в активности металлов влияют на их способность участвовать в окислительно-восстановительных реакциях.
В реакциях окисления металл теряет электроны и становится положительно заряженным ионом. Примером такой реакции может служить окисление железа, когда оно переходит вион Fe2+ в Fe3+. При этом железо теряет два электрона и окисляется.
В реакциях восстановления металл получает электроны и становится отрицательно заряженным. Например, восстановление меди, когда ион Cu2+ превращается в нейтральную медь Cu. При этом ион меди получает два электрона и восстанавливается.
Электрохимический ряд напряжений металлов позволяет предсказывать, какие металлы будут окисляться и восстанавливаться в реакции. Металлы, расположенные выше в ряду, обычно окисляют металлы, расположенные ниже в ряду. Эта информация полезна, например, для определения того, какое вещество может использоваться в качестве окислителя или восстановителя в химической реакции.
Влияние температуры на активность металлов в электрохимической реакции
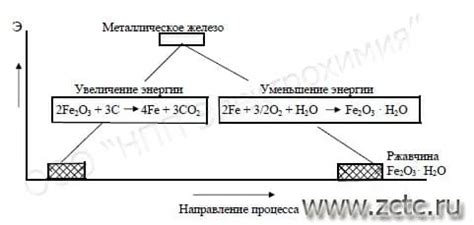
Температура играет важную роль в электрохимической реакции, оказывая влияние на активность металлов. При повышении температуры происходит увеличение скорости реакции и изменение электрохимического потенциала металла.
Повышение температуры приводит к увеличению кинетической энергии молекул металла, что способствует активации реакционных центров на его поверхности. Это ускоряет химическую реакцию, что делает металл более активным в электрохимической реакции.
Кроме того, повышение температуры влияет на электрохимический потенциал металла. Высокая температура может привести к смещению равновесия в реакции, что повлияет на направление потока электронов и изменение активности металла.
Однако следует отметить, что не все металлы одинаково реагируют на повышение температуры. Например, некоторые металлы, такие как железо или алюминий, могут образовывать оксидную пленку на своей поверхности при повышенных температурах, что может замедлить реакцию и уменьшить активность металла.
В целом, температура оказывает значительное влияние на активность металлов в электрохимической реакции. Повышение температуры может увеличить скорость реакции и изменить электрохимический потенциал металла, что делает его более или менее активным в реакции, в зависимости от свойств конкретного металла.
Примеры использования электрохимического ряда для активности металлов

Электрохимический ряд напряжений металлов является важным инструментом для определения активности металлов и их способности к окислительно-восстановительным реакциям. Этот ряд основан на том, как металлы взаимодействуют с растворами электролитов, и позволяет определить, какой металл будет действовать в качестве анода (положительного электрода) или катода (отрицательного электрода) в электрохимической реакции.
Пример использования электрохимического ряда для активности металлов - определение электродного потенциала металла. Электродный потенциал является мерой того, насколько металл способен вступать в электрохимические реакции. С помощью электрохимического ряда можно сравнивать электродные потенциалы различных металлов и определить, какой из них является более активным и будет работать в качестве анода, а какой менее активным и будет работать в качестве катода в электрохимической реакции.
Еще один пример использования электрохимического ряда - предсказание направления электрохимической реакции. Если известны электродные потенциалы двух металлов, можно предсказать, как будет проходить электрохимическая реакция между ними. Металл с более высоким электродным потенциалом будет вступать в окислительно-восстановительные реакции в качестве окислителя, а металл с более низким электродным потенциалом будет вступать в реакции восстановления. Поэтому электрохимический ряд позволяет предсказывать направление исходных реакций.
Другой пример использования электрохимического ряда - выбор материала для анода или катода в электрохимических процессах. Изучение электрохимического ряда позволяет определить наиболее стойкие металлы, которые меньше всего склонны к окислению или коррозии при работе в определенном окружающем среде. Таким образом, можно выбрать оптимальный материал для анода или катода, что повышает эффективность и долговечность электрохимических процессов.
Вопрос-ответ

Как использовать электрохимический ряд напряжений металлов?
Электрохимический ряд напряжений металлов позволяет определить активность металлов по их способности вступать в реакцию с растворами электролитов. Чем выше металл в ряду, тем больше его активность. Этот ряд можно использовать для предсказания результатов электрохимических реакций, например, при составлении реакционных схем или выборе правильного электрода для электролиза.
Какие металлы находятся вверху электрохимического ряда и почему?
Металлы, находящиеся вверху электрохимического ряда напряжений, являются более активными. Это связано с их большей способностью отдавать электроны и вступать в окислительно-восстановительные реакции. Верхние металлы в ряду, такие как литий, калий и натрий, имеют самых высокую активность и сильные окислительные свойства.
Какое значение имеет электрохимический ряд напряжений для электролиза?
Электрохимический ряд напряжений металлов используется при выборе правильного электрода для электролиза. В электролизе металл, находящийся выше в ряду, будет выделяться на полюсе анода, а металл, находящийся ниже, будет выделяться на полюсе катода. Таким образом, электрохимический ряд напряжений позволяет определить последовательность выделения металлов при электролизе и правильно выбрать электроды.
Как отражается активность металлов в электрохимическом ряду напряжений?
В электрохимическом ряду напряжений активность металлов отражается тем, насколько легко они отдают электроны и вступают в окислительные реакции. Металлы, находящиеся ближе к верху ряда, имеют более высокую активность и большую способность к окислению, в то время как металлы, находящиеся ниже, имеют меньшую активность и слабые окислительные свойства.
