Сернистая кислота (H2SO3) – одна из наиболее распространенных неорганических кислот, широко применяемая в различных отраслях промышленности. Одним из ее важных свойств является ее реакция с металлами, которая может протекать по различным схемам в зависимости от условий и типа металла. Реакции с металлами могут быть как высокоэнергетическими и взрывоопасными, так и спокойными и безопасными.
Сернистая кислота образует с металлами сульфаты, при этом в реакции может участвовать как весь металл, так и его ионы. В результате реакции образуется сернистокислый газ, который проявляет себя в виде продувающего горячего ядовитого пара. Для безопасного проведения реакции с сернистой кислотой необходимо строго соблюдать меры предосторожности и проводить реакцию в хорошо проветриваемом помещении или под вытяжным шкафом.
Примером реакции металлов с сернистой кислотой может служить реакция алюминия. В данной реакции алюминий, находящийся в порошкообразной форме, реагирует с сернистой кислотой, образуя сульфат алюминия и выделяя сернистокислый газ:
Al (s) + 3 H2SO3 (aq) → Al2(SO4)3 (aq) + 3 H2SO3 (g)
В данной реакции алюминий теряет свои металлические свойства и переходит в растворимую соль – сульфат алюминия. Выделяющийся сернистокислый газ вызывает жжение и раздражение слизистых оболочек органов дыхания, поэтому при работе с сернистой кислотой следует соблюдать особую осторожность.
Свойства реакции сернистой кислоты с металлами
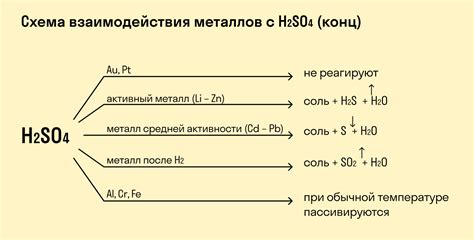
Химический реагент: Сернистая кислота (H2SO3).
Взаимодействие с металлами: Реакция сернистой кислоты с металлами происходит при присутствии воды и приводит к образованию солей сернистой кислоты.
Процесс: При контакте сернистой кислоты с металлами происходит окисление металла, а сернистая кислота восстанавливается до серной. В результате образуются соли сернистой кислоты и выделяется водород. Формула реакции может быть представлена следующим образом:
- Металл + H2SO3 → Соль металла + H2
Физические свойства: Реакция сернистой кислоты с металлами сопровождается выделением газообразного водорода и изменением цвета раствора кислоты. В результате образуется новое вещество - соль, которая обладает отличными химическими и физическими свойствами.
Примеры:
- Реакция железа с сернистой кислотой: Fe + H2SO3 → FeSO3 + H2
- Реакция меди с сернистой кислотой: Cu + H2SO3 → CuSO3 + H2
- Реакция цинка с сернистой кислотой: Zn + H2SO3 → ZnSO3 + H2
Химические свойства

Сернистая кислота, также известная как сульфитная кислота, обладает рядом химических свойств, которые позволяют ей реагировать с металлами. Одним из основных свойств сернистой кислоты является ее способность выступать в качестве сильного окислителя.
При контакте металлов с сернистой кислотой происходит окисление металла, при этом сернистая кислота превращается в сернокислоту. Процесс реакции зависит от типа металла и условий эксперимента.
Сернистая кислота может реагировать как с активными металлами, например, с цинком или железом, так и с менее активными металлами, например, с медью или свинцом. Реакция с активными металлами протекает более интенсивно, с выделением газов (например, сернистый газ) и образованием соответствующих солей сернистой кислоты.
Примером реакции сернистой кислоты с металлом может служить реакция сернистой кислоты с цинком. В результате такой реакции образуется сульфат цинка и выделяется сернистый газ:
Zn + H2SO3 → ZnSO3 + H2S↑
Механизм реакции

Реакция сернистой кислоты с металлами происходит в несколько этапов и имеет особенности, свойственные данному типу химических взаимодействий.
Первым этапом реакции является диссоциация сернистой кислоты в воде. Под воздействием воды молекулы сернистой кислоты распадаются на ионы сернистого аниона SO3^-2 и протонов H^+, которые растворяются в воде.
Далее происходит активация поверхности металла, которая обусловлена образованием комплексов с протонами из раствора. Это способствует образованию активных центров на поверхности металла, которые могут участвовать в дальнейших реакциях.
Следующим этапом является окисление металла протонами сернистой кислоты. Протоны передаются с активных центров металла на поверхностные атомы кислорода, что приводит к образованию оксида металла и воды.
Итоговым продуктом реакции является соответствующий оксид металла и сернистая кислота, которая может продолжать участвовать в последующих реакциях.
Примеры реакций

Реакция сернистой кислоты с металлами включает в себя образование соответствующих сульфатов. Например, медь и сернистая кислота реагируют между собой, образуя сульфат меди:
- 2Cu + H2SO4 → CuSO4 + SO2 + H2O
Реакция магния с сернистой кислотой также приводит к образованию сульфата магния:
- Mg + H2SO4 → MgSO4 + H2
Реакция цинка с сернистой кислотой дает сульфат цинка и выделение сероводорода:
- Zn + H2SO4 → ZnSO4 + H2S
Реакция алюминия с сернистой кислотой приводит к образованию сульфата алюминия и выделению сероводорода:
- 2Al + 3H2SO4 → Al2(SO4)3 + 3H2S
Таким образом, реакция сернистой кислоты с металлами является типичным примером образования солей при взаимодействии агрессивных реагентов.
Вопрос-ответ

Какие свойства имеет сернистая кислота?
Сернистая кислота имеет характерный запах и легко растворяется в воде. Она обладает кислотными свойствами и может образовывать соли.
Как проходит реакция сернистой кислоты с металлами?
Реакция сернистой кислоты с металлами протекает по следующей схеме: металл + сернистая кислота = соль металла + сероводород. В результате реакции образуется соль металла и выделяется сероводород.
Приведите пример реакции сернистой кислоты с металлом.
Примером реакции сернистой кислоты с металлом может служить реакция меди с сернистой кислотой: Cu + H2SO3 = CuSO3 + H2.
Какие соли образуются в результате реакции сернистой кислоты с металлами?
При реакции сернистой кислоты с металлами образуются соли, например, сульфиты. Например, реакция железа с сернистой кислотой приводит к образованию сульфита железа (FeSO3).
