Определение, является ли металл катодом или анодом, важно при работе с электрохимическими явлениями, такими как гальваническая коррозия, электролиз или элементы батарей. Правильное определение является либо очень простым, либо довольно сложным, в зависимости от ситуации.
Для начала, необходимо знать, что катод — это электрод, на который идет поток электронов или их отталкивание, а анод — это электрод, с которого исходит поток электронов. В обычной ситуации, более активный металл склонен быть анодом, ибо он окисляется, а менее активный металл будет катодом, где происходит восстановление.
Определение активности металла можно провести на основе табличных данных или при помощи эксперимента.
В таблицах электрохимической активности, таких как таблица потенциалов стандартной водородной шкалы (таблица электродных потенциалов) или другие аналогичные таблицы, можно найти информацию о том, как металлы взаимодействуют с электродами и какие значения имеет их потенциал. Обычно более активные металлы имеют более положительное значение потенциала, следовательно, они склонны быть анодами. Менее активные металлы, наоборот, имеют более отрицательное значение потенциала и склонны быть катодами.
Определение активности металла в электролитической ячейке
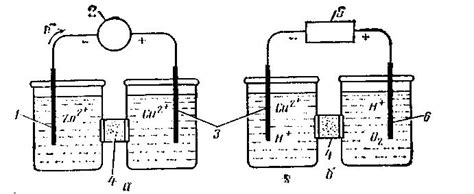
Определить активность металла в электролитической ячейке очень важно, так как она показывает, является ли данный металл катодом или анодом при электролизе. Активность металла определяет его способность отдавать или принимать электроны. Катод и анод – это два электрода, размещенных в электролите и способные участвовать в электролизе.
Если металл способен вступать во взаимодействие с положительно заряженными ионами, то он выступает в роли катода, принимая электроны и происходит восстановление металла на электроде. Активным катодом является металл, который имеет низкую стандартную потенциальную разность, то есть способен сильнее принимать электроны.
С другой стороны, если металл способен вступать во взаимодействие с отрицательно заряженными ионами, то он выступает в роли анода, отдающего электроны и происходит окисление металла на электроде. Активным анодом является металл, который имеет высокую стандартную потенциальную разность, то есть способен сильнее отдавать электроны.
Определить активность металла можно по таблице стандартной потенциальной разности металлов. В этой таблице металлы упорядочены по их способности восстановления или окисления. Чем выше металл располагается в таблице, тем активнее он является. Металлы, расположенные ближе к верху таблицы, обладают большей активностью, чем металлы, находящиеся ниже.
Таким образом, определение активности металла в электролитической ячейке позволяет нам определить его роль – катода или анода – и понять, как будет происходить процесс электролиза. Знание активности металла важно для электролиза различных растворов и солей, а также для понимания химических реакций, происходящих на электродах.
Что такое активность металла?

Активность металла - это свойство металла проявлять способность вступать в реакции с другими веществами. Она определяется его склонностью отдавать или принимать электроны при химических взаимодействиях. Активность металла напрямую связана с его позицией в ряду активности металлов.
Ряд активности металлов представляет собой упорядоченный список металлов от самых активных до наименее активных. В основе этого ряда лежит электрохимический ряд напряжений, который показывает потенциалы окисления различных металлов.
На верхней части ряда активности находятся металлы, которые имеют большую склонность отдавать электроны и содержатся в ионном состоянии с положительным зарядом (катионы). Такие металлы называются активными и обладают большей степенью окислительной способности.
На нижней части ряда активности находятся металлы, которые имеют меньшую склонность отдавать электроны и представлены восстановленным состоянием с отрицательным зарядом (анионы). Эти металлы считаются менее активными.
Активность металла определяет его поведение в различных химических процессах, включая электролиз и гальванические элементы. В реакциях с другими металлами анализ активности помогает определить, какой металл станет катодом (получит электроны) или анодом (отдаст электроны).
Что такое катод и анод?

Катод и анод являются основными понятиями в электрохимии и электротехнике. Они определяют положительное или отрицательное направление электрического тока в электролите или электрической цепи.
Катод – это электрод, на котором происходит восстановление или прием электронов. В химических процессах катод может быть оболочкой, в которой происходит редокс-реакция, то есть передача электронов от окислителя к восстановителю. Катод соединяется с положительным полюсом источника электрической энергии.
Анод – это электрод, с которого происходит окисление или потеря электронов. В реакциях анод является источником электронов, которые направляются через источник энергии к катоду для того, чтобы произвести необходимые химические или электрохимические изменения. Анод соединяется с отрицательным полюсом источника электрической энергии.
В электролизе и гальванических элементах катод и анод играют ключевую роль в обеспечении протекания электрического тока. Они определяют направление движения электронов и ионы в электрической цепи. Катод и анод являются важными элементами при проведении различных электрохимических процессов и в создании электрических устройств.
В таблице потенциалов стандартных электродов, катоды имеют положительный знак, а аноды – отрицательный. При этом потенциал катода относительно анода обозначается как положительный, так как потенциалные разности измеряются в концентрации, при которой избыточно электронов передается с анода на катод и наоборот.
Примеры определения активности металла в электролитической ячейке

В электролитической ячейке активность металла может быть определена путем измерения потенциала и его изменений связанных с процессами окисления и восстановления. Рассмотрим несколько примеров.
1. Определение активности алюминия и меди. В ячейке помещают два электрода - алюминиевый и медный. После подключения источника тока, проводят измерение потенциала между электродами. Если потенциал медного электрода положителен относительно алюминиевого, то медь будет являться катодом, алюминий - анодом. Это говорит о том, что медь более активный металл по сравнению с алюминием.
2. Определение активности цинка и железа. В ячейке помещают цинковый и железный электроды. Измеряется потенциал между ними. Если потенциал цинкового электрода отрицателен по отношению к железному, то цинк будет являться анодом, а железо - катодом. Таким образом, цинк активнее железа.
3. Измерение активности металлов методом потенциостатической поляризации. В данном методе применяется специальное оборудование - потенциостат. С его помощью измеряется потенциал между электродами в процессе потенциостатической поляризации. Исследуемые металлы находятся в одном электролите. По изменению потенциала можно определить, какой металл является активным и будет анодом, а какой - менее активным и будет катодом.
Все эти методы помогают определить активность металла в электролитической ячейке и выяснить, является ли он анодом или катодом в реакции окисления-восстановления.
Вопрос-ответ

Как определить, что это за металл? Мне нужно знать его химические свойства?
Да, для определения, является ли металл катодом или анодом, необходимо знать его химические свойства. Важно понять, как металл взаимодействует с окружающей средой и сравнить его активность с другими металлами в данной реакции.
Могут ли металлы менять свою роль и быть как катодом, так и анодом, в зависимости от условий?
Да, некоторые металлы могут менять свою роль и действовать как катоды или аноды в зависимости от условий. Например, в одной реакции металл может выступать в роли катода, а в другой – в роли анода. Это зависит от потенциала окисления металла и его способности принимать или отдавать электроны.
Если я знаю, что один металл является активнее другого, это означает, что он будет всегда выступать в роли анода?
Нет, активность металла не всегда гарантирует, что он будет всегда выступать в роли анода. Важно учитывать условия реакции и потенциал окисления металла. Некоторые металлы могут быть более активными, но при некоторых условиях они могут выступать в роли катода.
Может ли металл быть одновременно катодом и анодом в одной и той же реакции?
Нет, металл не может быть одновременно катодом и анодом в одной и той же реакции. В реакции один металл будет выступать в роли катода, а другой – в роли анода. Именно эта разница в потенциале окисления металлов позволяет определить их роль в реакции.
