Реакция замещения – один из основных типов химических реакций, которые происходят при взаимодействии различных веществ. В ходе такой реакции атомы или группы атомов одного вещества замещаются атомами или группами атомов другого вещества. Такие реакции широко используются в химической промышленности и имеют большое значение во многих отраслях науки и техники.
Один из наиболее известных примеров реакции замещения – взаимодействие кислот с металлами. Кислоты содержат в своей структуре водород, который может быть замещен металлами. При этом образуются соли и выделяется водород. Например, при взаимодействии соляной кислоты с металлом железа, образуется хлорид железа и выделяется водородный газ:
2HCl + Fe → FeCl2 + H2
Кроме того, реакции замещения происходят и между различными солями. Например, при взаимодействии сульфата меди(II) с нитратом цинка образуются сульфат цинка и нитрат меди(II):
CuSO4 + Zn(NO3)2 → ZnSO4 + Cu(NO3)2
Таким образом, реакции замещения играют важную роль в химии и имеют много разнообразных применений. Они позволяют получать новые вещества с желаемыми свойствами и используются в процессе синтеза различных соединений. Также эти реакции являются основой для создания различных катализаторов и процессов в химической промышленности.
Взаимодействие кислот с водородом

Кислоты - это вещества, которые образуются при соединении водорода с отрицательными радикалами. Такие соединения могут быть растворены в воде, и в результате образуют кислоту.
Взаимодействие кислот с водородом происходит по реакции замещения. В этом процессе водород из кислоты замещается другими элементами, при этом образуется вода и соли.
Когда кислоты взаимодействуют с водородом, они образуются ионы водорода, H+, которые являются основной причиной кислотности. Вода, которая образуется в результате реакции, является главным продуктом взаимодействия кислот с водородом.
Примером такого взаимодействия является реакция соляной кислоты с водородом. В результате образования ионов водорода и хлорида, образуется хлористый водород или соляная кислота:
- HCl + H2O → H3O+ + Cl-
Перед взаимодействием с водородом, кислоты могут существовать в различных степенях диссоциации. Степень диссоциации кислоты зависит от ее химического состава и условий окружающей среды.
Примеры реакций замещения в химии

1. Реакция замещения кислоты с металлом:
Одним из примеров реакции замещения в химии является реакция металла с кислотой. В результате такой реакции происходит замещение водорода в кислоте металлом. Например, при взаимодействии меди с соляной кислотой образуется хлорид меди и выделяется водород.
2. Реакция замещения металла с солью:
Другим примером реакции замещения в химии является реакция металла с солью. При этом металл замещает из соли ион другого металла, образуя соответствующую соль. Например, реакция цинка с медным (II) сульфатом приводит к образованию сульфата цинка и осаждению меди.
3. Реакция замещения металла с водородом:
Еще одним примером реакции замещения в химии является реакция металла с водородом. В такой реакции металл замещает водород в соединении, образуя соответствующую соль. Например, при взаимодействии натрия с водой образуется гидроксид натрия и выделяется водород.
Таким образом, реакции замещения в химии представляют собой важный класс химических превращений, где происходит замещение одного элемента или группы элементов другими.
Взаимодействие металлов с водородом

Взаимодействие металлов с водородом является одной из наиболее характерных реакций замещения в химии. При этом происходит выделение водорода и образование соответствующих металлических солей.
Водород является элементом, способным реагировать с большинством металлов. Реакция металла с водородом происходит при нагревании или взаимодействии с кислотами. Реакция может быть сопровождена выделением тепла и пламени, особенно при взаимодействии с металлами группы сильных металлореагентов.
Например, реакция натрия с водородом приводит к образованию гидрида натрия и выделению гидрогена по следующей схеме: 2Na + H2 → 2NaH.
Также можно выделить реакцию калия с водородом, в результате которой образуется гидрид калия и выделяется гидроген: 2K + H2 → 2KH.
Взаимодействие металлов с водородом имеет множество применений в различных областях. Например, водород является чрезвычайно важным энергетическим носителем и может быть использован в процессе прямого реакционного синтеза для получения чистых металлических солей.
Примеры реакций замещения в химии

Реакции замещения - это один из важных типов химических реакций, при котором один элемент замещается другим в химическом соединении. Эти реакции происходят в результате обмена ионами или атомами и могут происходить в растворах или в твердом состоянии.
Примером реакции замещения может служить реакция между металлами и кислотами. Например, реакция между цинком и соляной кислотой:
- Цинк вступает в реакцию с соляной кислотой, освобождая молекулы водорода и образуя соли.
- Уравнение реакции: Zn + 2HCl → ZnCl2 + H2.
Другим примером реакции замещения является реакция между металлом и его солью. Например, реакция между медью и серной кислотой:
- Медь замещает металл в соли, образуя серу и обновленную соль.
- Уравнение реакции: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O.
Реакции замещения также могут происходить между металлами разной активности. Например, реакция между железом и медью:
- Железо замещается медным и образует соль меди и железо.
- Уравнение реакции: Fe + CuSO4 → Cu + FeSO4.
Эти примеры демонстрируют различные варианты реакций замещения в химии и позволяют прояснить механизмы этих реакций.
Взаимодействие солей с водородом
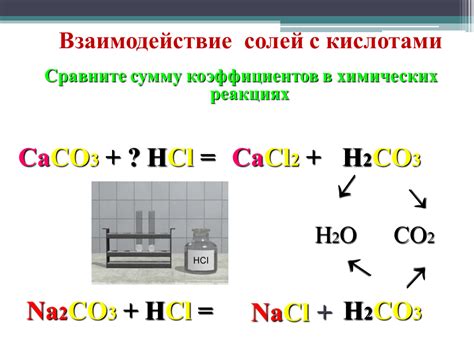
Соли представляют собой химические соединения, состоящие из положительно и отрицательно заряженных ионов. Взаимодействие солей с водородом может происходить при наличии содержащихся в соли кислородсодержащих групп, способных отдавать протоны. Это взаимодействие обычно происходит в водных растворах, где водородные ионные группы могут вступать в реакцию.
Одним из примеров таких реакций является взаимодействие кислотных солей с водородом. Кислотные соли содержат положительную часть и отрицательную кислотную группу. При взаимодействии с водородом, данный ионный комплекс вступает в химическую реакцию, протекающую с образованием соединений, содержащих гидроксидные группы.
Другим примером взаимодействия солей с водородом является обратная реакция, когда гидроксидные соли выступают в роли ионов способных принять протоны от водорода. В результате таких реакций могут образовываться новые соединения, в которых гидроксидные группы действуют в качестве оснований и проявляют амфотерное свойство.
Таким образом, взаимодействие солей с водородом является важным процессом в химии, который позволяет образовывать новые соединения с основными или кислотными свойствами в зависимости от ионного комплекса, вступающего в реакцию.
Примеры реакций замещения в химии

Реакция замещения - это химическая реакция, в которой один элемент или группа элементов замещаются другими элементами или группами элементов в химическом соединении. Это происходит при взаимодействии различных веществ, таких как кислоты, металлы и соли с водородом.
Одним из примеров реакции замещения является реакция кислоты и металла. Например, реакция соляной кислоты (HCl) с цинком (Zn) приводит к образованию хлорида цинка (ZnCl2) и выделению водорода (H2):
- HCl + Zn → ZnCl2 + H2
Другим примером реакции замещения является взаимодействие металлов и солей с водородом. Например, реакция металла цинка (Zn) с соляной кислотой (HCl) приводит к образованию соли — хлорида цинка (ZnCl2) — и выделению водорода (H2):
- Zn + 2HCl → ZnCl2 + H2
Также реакция замещения может происходить между металлом и солью. Например, реакция железа (Fe) с раствором серной кислоты (H2SO4) приводит к образованию соли — сульфата железа (FeSO4) — и выделению водорода (H2):
- Fe + H2SO4 → FeSO4 + H2
Такие реакции замещения широко используются в химической промышленности и лабораторных условиях для синтеза различных соединений и получения веществ с определенными химическими свойствами.
Роль водорода в реакциях замещения

Водород играет важную роль в реакциях замещения, которые являются одним из основных типов химических реакций. Реакции замещения происходят, когда одно вещество замещается другим в химической реакции.
Водород может замещаться другими элементами в различных соединениях. Например, кислоты, содержащие водород, могут подвергаться реакции замещения с металлами или солями. В результате таких реакций образуются новые соединения и выделяется газ водород.
В реакциях замещения водород может быть вытеснен другими элементами из соединений. Например, когда металл вступает в реакцию с кислотой, он вытесняет водород из кислоты, образуя металлическую соль и выделяя газ водород.
Реакции замещения, в которых участвует водород, имеют широкое применение в промышленности и в повседневной жизни. Например, водородные реакции используются для производства аммиака, водорода и других химических соединений.
Таким образом, водород играет важную роль в реакциях замещения и является активным участником химических превращений. Различные реакции замещения с участием водорода позволяют получать новые соединения и использовать их в различных областях науки и техники.
Вопрос-ответ

Какие примеры реакции замещения можно найти в химии?
В химии существует множество примеров реакции замещения. Один из самых известных примеров - реакция между кислородом и водородом, которая приводит к образованию воды: 2H2 + O2 → 2H2O. Кроме того, такие взаимодействия могут происходить между кислотами и металлами, а также между солями и водородом.
Какие кислоты могут образовывать соли с металлами?
В химии существуют различные кислоты, которые могут образовывать соли с металлами. Например, соляная кислота (HCl) может образовывать соль хлорида с металлами, такими как натрий (NaCl), калий (KCl) и многими другими. Серная кислота (H2SO4) может образовывать соль сернокислого металла, например, сернокислого железа (FeSO4) или сернокислого натрия (Na2SO4).
Как происходит реакция замещения кислот с водородом?
Реакция замещения кислот с водородом происходит путем замещения водорода в кислоте другими элементами или соединениями. Например, при взаимодействии хлороводорода (HCl) с металлом цинком (Zn), водород в кислоте замещается металлом, образуя хлорид цинка (ZnCl2) и выделяясь водородный газ (H2): Zn + 2HCl → ZnCl2 + H2. Подобные реакции замещения кислот с водородом также могут протекать с другими металлами и кислотами, в зависимости от их химических свойств и реакционных условий.
