Один из ключевых аспектов структуры атома металлов - количество электронов, которые находятся на внешнем энергетическом уровне. Внешний энергетический уровень также известен как валентная оболочка, и он играет важную роль в химической активности металлов.
На внешнем энергетическом уровне металлов находятся валентные электроны. Именно они взаимодействуют с другими атомами при образовании химических соединений. Валентные электроны определяют химические свойства металлов и их способность образовывать ионы или связываться с другими элементами.
Количество валентных электронов на внешнем энергетическом уровне может быть различным для разных металлов. Например, алкалийные металлы, такие как литий, натрий и калий, имеют один валентный электрон, который легко отделяется. Благодаря этому они имеют высокую активность и способность образовывать ионы с положительным зарядом.
Подводя итог, количество электронов на внешнем энергетическом уровне металлов играет важную роль в их химических свойствах и способности взаимодействовать с другими элементами. Оно определяет активность металлов и их способность образовывать соединения. Понимание этого аспекта помогает расширить наши знания о металлах и их использовании в различных сферах науки и промышленности.
Внешний энергетический уровень металлов: количество электронов и его значение
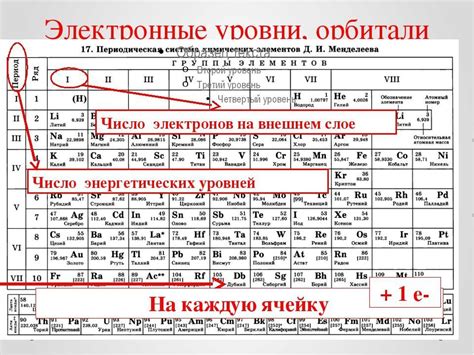
Внешний энергетический уровень металлов определяется количеством электронов, расположенных на самом последнем энергетическом уровне атома металла. Этот уровень называется валентным энергетическим уровнем и его количество электронов в значительной степени определяет физические и химические свойства металлов.
Количество электронов на внешнем энергетическом уровне металлов может варьироваться в зависимости от элемента. Однако, большинство металлов имеют неполный внешний энергетический уровень, то есть на нем расположено меньше электронов, чем может быть максимально заполнено. Неполный внешний энергетический уровень обуславливает особую реакционность металлов и способность образовывать химические связи с другими веществами.
Валентность металлов, то есть количество электронов на внешнем энергетическом уровне, является важным показателем их способности образовывать химические связи. Чем больше электронов на внешнем энергетическом уровне, тем большую роль играют металлы в качестве доноров электронов. Это позволяет им образовывать ионы положительного заряда и вступать в химические реакции с другими элементами.
Количество электронов на внешнем энергетическом уровне также определяет свойства металлов, такие как теплопроводность и электропроводность. Большое количество электронов на внешнем энергетическом уровне способствует высокой подвижности электронов в металлах, что обусловливает их хорошую проводимость как тепла, так и электричества.
Общие понятия внешнего энергетического уровня

Внешний энергетический уровень относится к энергетическим уровням атома, на котором находятся внешние электроны. Все атомы стремятся достигнуть стабильности, заполнив свой внешний энергетический уровень электронами.
Количество электронов на внешнем энергетическом уровне определяет химические свойства элемента и его способность образовывать связи с другими атомами. Внешний энергетический уровень может быть открытым или закрытым, в зависимости от того, насколько полностью он заполнен электронами.
Если внешний энергетический уровень полностью заполнен электронами, то атом обладает высокой тенденцией к стабильности и образует связи редко. Элементы с полностью заполненными внешними энергетическими уровнями называются инертными газами.
Если внешний энергетический уровень неполностью заполнен электронами, то атом обладает высокой реакционной способностью и образует связи легко. Элементы, имеющие неполностью заполненные внешние энергетические уровни, относятся к группе металлов.
Неметаллы и количество электронов на внешнем энергетическом уровне
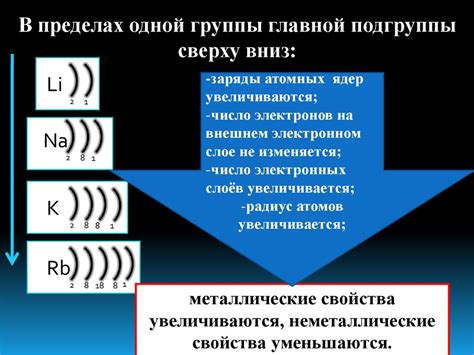
Неметаллы характеризуются различными свойствами, включая гибкость, прочность и электропроводность. Основным отличием неметаллов от металлов является количество электронов на внешнем энергетическом уровне.
На внешнем энергетическом уровне неметаллов находится обычно от 4 до 8 электронов. Это означает, что неметаллы обладают более высокой электроотрицательностью, чем металлы. За счет большего количества электронов на внешнем энергетическом уровне, неметаллы обладают сильной способностью к образованию химических связей.
Неметаллы обычно образуют ковалентные связи, при которых электроны с внешнего энергетического уровня одного атома образуют связь с электронами с внешнего энергетического уровня другого атома. Это обусловлено тем, что неметаллы стремятся заполнить или освободить свою валентную оболочку, чтобы достичь более стабильного энергетического состояния.
Количество электронов на внешнем энергетическом уровне неметаллов также может влиять на их физические свойства. Например, неметаллы с более низким количеством электронов на внешнем энергетическом уровне обычно имеют низкую температуру плавления и кипения, а также низкую электропроводность.
Таким образом, количество электронов на внешнем энергетическом уровне играет важную роль в определении свойств неметаллов и их способности образовывать химические связи с другими элементами.
Металлы и их внешний энергетический уровень
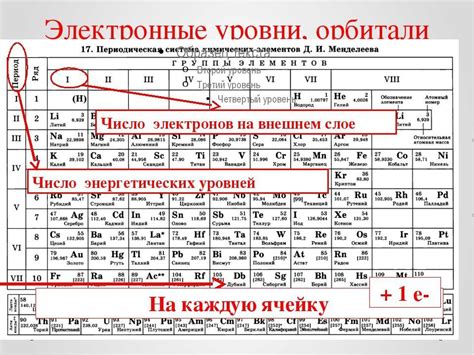
В химии, энергетический уровень — это энергия, принадлежащая электрону в атоме или молекуле. Одной из особенностей металлов является то, что у них на внешнем энергетическом уровне находится небольшое количество электронов.
Внешний энергетический уровень металлов играет ключевую роль в их химических свойствах и взаимодействиях с другими веществами. Низкая энергия электронов на этом уровне позволяет металлам образовывать легко ионизируемые катионы и проявлять металлические свойства, такие как хорошая электропроводность и теплопроводность.
На внешнем энергетическом уровне металлов обычно находится от одного до трех электронов. Это обуславливает их способность к образованию положительного ионного заряда, когда эти электроны переносятся другим веществам. Именно эти ионы обуславливают реактивность металлов, такую как растворимость и реактивность с кислотами или другими веществами.
Внешнему энергетическому уровню металлов также свойственна способность образовывать металлические связи. Это возможно благодаря наличию свободных электронов на внешнем энергетическом уровне, которые могут свободно передвигаться между атомами металла и создавать межатомные связи. Это обеспечивает высокую плотность и прочность металлических материалов.
Вопрос-ответ

Сколько электронов на внешнем энергетическом уровне металлов?
Количество электронов на внешнем энергетическом уровне металлов зависит от их положения в периодической системе элементов. Например, у металлов в первом периоде, таких как литий, натрий, калий, на внешнем энергетическом уровне находится по одному электрону. У металлов во втором периоде, таких как магний, алюминий, на внешнем энергетическом уровне находятся два электрона. У металлов в третьем периоде, например, кальций, на внешнем энергетическом уровне находятся также два электрона. Таким образом, количество электронов на внешнем энергетическом уровне металлов может быть разным в зависимости от их положения в периодической системе.
Какие металлы имеют один электрон на внешнем энергетическом уровне?
Металлы, которые имеют один электрон на внешнем энергетическом уровне, находятся в первом периоде периодической системы элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов на внешнем энергетическом уровне находится один электрон, что делает их химически активными и склонными образовывать ионные соединения с не-металлами.
Каким образом количество электронов на внешнем энергетическом уровне металлов влияет на их свойства?
Количество электронов на внешнем энергетическом уровне металлов оказывает влияние на их свойства. Металлы с одним или двумя электронами на внешнем энергетическом уровне обладают большей химической активностью и склонностью к образованию ионных соединений. Металлы с полностью заполненным внешним энергетическим уровнем, такие как инертные газы восьмой группы периодической системы элементов (гелий, неон, аргон и т. д.), обычно не образуют ионные соединения и реакционно неактивны.
