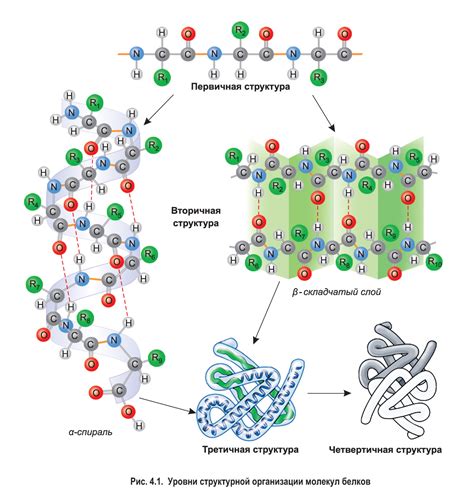
Молекула ЭДТА (этилендиаминтетрауксусная кислота) является ключевым соединением в координационной химии и аналитической химии металлов. Она имеет высокую дентатность, то есть способность образовывать связи с несколькими атомами металлов. Это позволяет ей образовывать стабильные комплексы с различными ионами металлов.
Структура молекулы ЭДТА включает в себя четыре азотистых атома, находящихся на концах центрального этилендиаминного фрагмента, и две карбоксильные группы, представленные на углеродных атомах. Благодаря этим функциональным группам, ЭДТА обладает высокой производительностью в образовании комплексов с ионами металлов.
Способность молекулы ЭДТА образовывать хелаты с металлами основана на принципе комплексообразования, где центральный атом металла образует координационные связи с атомами азота и кислорода молекулы ЭДТА.
В результате образуется мономерная комплексная молекула металла и ЭДТА, которая обладает стабильностью и способностью к дальнейшим химическим реакциям. Этот процесс играет важную роль в химических анализах, так как позволяет определить концентрацию металлов в различных образцах с высокой точностью.
Молекула ЭДТА: структура и свойства
ЭДТА (этилендиаминтетрауксусная кислота) - это органическое вещество, которое широко используется в химии и аналитической химии. Оно имеет сложную структуру, состоящую из этилендиаминной части и четырех карбоксилатных групп, связанных с атомами азота. Этот комплексообразующий агент обладает уникальными свойствами, позволяющими ему образовывать стабильные хелатные соединения с различными металлами.
Молекула ЭДТА обладает максимальной дентатностью, то есть способностью образовывать комплексы с максимальным количеством донорных атомов. В аналитической химии она широко используется в виде свободной или ее натриевой соли, которые способны образовывать хелаты с различными металлами при рН около 5-6.
Стабильность хелатных комплексов, образующихся между ЭДТА и металлами, основана на сильной координационной способности карбоксилатных групп и каффиновской структуре молекулы. При этом каждая из карбоксилатных групп координируется с отдельным атомом металла, образуя циклический комплекс, что делает хелаты стабильными.
Молекула ЭДТА обладает также амфотерными свойствами, то есть способностью взаимодействовать как с металлами, так и с протонами. Это позволяет использовать ее не только для образования хелатных соединений, но и для регулирования рН растворов и комплексообразования металлов в различных условиях.
Молекула ЭДТА: химический состав и формула

ЭДТА (этилендиаминтетрауксусная кислота) - это органическое соединение, которое широко используется в аналитической химии и биохимии. Его формула C10H16N2O8 указывает на сложность структуры этой молекулы.
Химический состав ЭДТА позволяет ему образовывать стабильные комплексы с многими металлами. Молекула ЭДТА обладает максимальной дентатностью - каждый из атомов азота и карбоната, а также все карбоксильные группы могут образовывать координационные связи с металлом. В результате образуются металлические хелаты, в которых металл находится в центре молекулы ЭДТА, окружённый лигандами.
ЭДТА используется в различных областях химии и биологии. Один из его наиболее распространенных применений - это использование его свойств для хелатирования ионов металлов. Благодаря своей высокой способности координировать металлы, ЭДТА используется в качестве реагента для определения концентрации металлов в различных образцах. Также ЭДТА можно использовать в медицине в качестве антикоагулянта при сборе крови для анализа.
Для удобства работы с ЭДТА его обычно используют в виде его натриевой или дизамещенной соли. Это обеспечивает лучшую растворимость и стабильность соединения при различных условиях. Кроме того, в зависимости от замещения атомов в молекуле, можно модифицировать свойства ЭДТА для различных приложений.
Молекула ЭДТА имеет сложную структуру, но благодаря своим уникальным свойствам она нашла применение в различных областях химии и биологии. Ее способность образовывать устойчивые хелатные соединения с металлами делает ее одним из наиболее полезных и широко используемых реагентов в аналитической химии и биохимии.
Молекула ЭДТА: функции и области применения
Молекула этилендиаминтетрауксусной кислоты (ЭДТА) является одним из наиболее универсальных комплексообразующих агентов. Благодаря своему способу связывать металлы, она нашла широкое применение в различных областях науки и промышленности.
Одной из главных функций молекулы ЭДТА является образование стабильных хелатных комплексов с металлами. При контакте с ионами металлов, молекула ЭДТА образует с ними комплекс, устойчивый как в кислых, так и в щелочных растворах. Это позволяет использовать ее в качестве хелатирующего агента для удаления тяжелых металлов из природных и промышленных сточных вод.
Молекула ЭДТА также широко применяется в аналитической химии для оценки содержания ионов металлов в растворах. Она используется в качестве индикатора, образуя окрашенные комплексы с определенными металлами. Методы, основанные на использовании ЭДТА, позволяют определить содержание металлов с высокой точностью и чувствительностью.
Также молекула ЭДТА находит применение в промышленности, особенно в текстильной и пищевой отраслях. Она используется для смягчения жесткой воды, что позволяет предотвратить осаждение нерастворимых солей на поверхности тканей и на оборудовании пищевых производств. Кроме того, ЭДТА применяется в качестве стабилизатора и консерванта в пищевых продуктах.
В заключение, молекула ЭДТА обладает высокой функциональностью и широким спектром применения. Она находит применение в области очистки воды, аналитической химии, промышленных процессах, текстильной и пищевой отраслях. Молекула ЭДТА является незаменимым инструментом для работы с металлами и их ионами.
Молекула ЭДТА: дентатность и образование хелатов
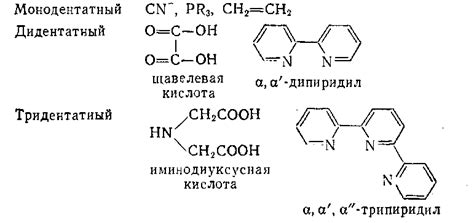
Молекула ЭДТА (этилендиаминтетрауксусная кислота) является уникальным комплексообразующим агентом, используемым в химии и аналитической химии для образования стабильных хелатных соединений с различными металлами. Дентатность ЭДТА определяется способностью ее атомов кислорода и азота донорно связываться с металлами, образуя комплексы.
Молекула ЭДТА содержит шесть функциональных групп, которые могут связаться с металлами: четыре атома кислорода от карбоксильных групп и два атома азота от аминных групп. Таким образом, ЭДТА обладает максимальной дентатностью, равной шести, что позволяет ей эффективно образовывать хелатные соединения с металлами различной степени окисления.
При образовании хелатных комплексов молекула ЭДТА обычно формирует стабильные пяти- и шестисвязные комплексы с металлами, в которых атомы металла погружаются внутри кольца молекулы. Такие комплексы существуют в виде цветных соединений, которые широко используются в аналитической химии для определения металлов и в различных процессах, таких как очистка воды и медицинский диагноз.
Образование хелатов с помощью ЭДТА позволяет значительно увеличить стабильность и растворимость соединений металлов, а также обеспечивает контроль над их химическими и физическими свойствами. Кроме того, хелатные комплексы с металлами могут использоваться в качестве катализаторов, красителей или лекарственных препаратов.
Использование молекулы ЭДТА и образование хелатов с металлами имеют широкие практические применения и являются важным инструментом в химическом и аналитическом исследовании. Благодаря своей дентатности и способности образовывать стабильные комплексы, ЭДТА играет ключевую роль в различных сферах науки и технологии, способствуя развитию новых материалов и технологий.
Молекула ЭДТА: хелатообразование с металлами
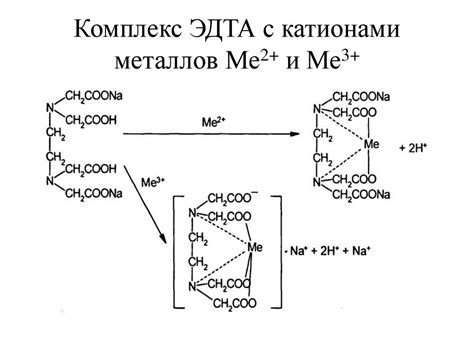
Молекула этилендиаминтетрауксусной кислоты (ЭДТА) является одним из наиболее эффективных лигандов для образования комплексов с различными металлами. Благодаря своей многоатомной структуре, ЭДТА может образовывать хелатные комплексы с максимальной дентатностью. Это означает, что каждый атом кислорода и азота в молекуле ЭДТА может образовать связь с металлом, обеспечивая стабильность и эффективность хелатообразования.
Хелатообразование с металлами – это процесс образования комплексов, в которых молекула ЭДТА образует кольцевые структуры вокруг металла. При этом каждый атом кислорода или азота в молекуле ЭДТА образует связь с металлом, образуя стабильные комплексы.
Молекула ЭДТА обладает высокой аффинностью к металлам с различными зарядами и валентностями благодаря своей структуре и особым химическим свойствам. Это делает ее универсальным лигандом для образования хелатных комплексов с различными металлами, такими как кальций, железо, цинк и многими другими.
Хелатные комплексы, образованные с помощью молекулы ЭДТА, имеют множество применений в различных областях, таких как медицина, аналитическая химия и промышленность. Они часто используются для стабилизации и усиления эффективности различных процессов, в том числе при очистке и обезжелезивании воды, а также при производстве фармацевтических препаратов и косметических средств.
Молекула ЭДТА: свойства и применение в аналитической химии
ЭДТА (этилендиаминтетрауксусная кислота) — комплексообразующий агент, используемый в аналитической химии для определения ионов металлов. Она обладает высокой степенью дентатности благодаря наличию шести центров координации, что позволяет ей образовывать стабильные комплексы с различными металлами.
Молекула ЭДТА образует хелатные комплексы, то есть межмолекулярные соединения, в которых металл и центральный атом ЭДТА связаны ковалентной связью. Это свойство позволяет использовать ЭДТА для комплексообразования ионов металлов, что является основой многих методов химического анализа.
В аналитической химии ЭДТА применяется для титрования растворов металлов, например, для определения концентрации кальция в воде или жесткости воды. Этот метод основан на образовании стабильного комплекса между ионами кальция и ЭДТА, который имеет характерные свойства, позволяющие определить точную концентрацию ионов металла.
Кроме того, молекула ЭДТА используется в комплексометрическом анализе для определения содержания металлов в различных образцах, таких как пищевые продукты, промышленные отходы или почвенные пробы. Она применяется в различных областях аналитической химии, где требуется определение концентрации металлов с высокой точностью.
Молекула ЭДТА: преимущества и недостатки применения

Этилендиаминтетрауксусная кислота (ЭДТА) – это комплексообразующее вещество, которое широко используется в различных областях, таких как химическая аналитика, медицина и пищевая промышленность. Ее применение обусловлено несколькими преимуществами, которые позволяют получать стабильные и реакционно-способные соединения.
Преимущество использования молекулы ЭДТА заключается в ее высокой дентатности, то есть способности образовывать комплексы с металлами. Данное соединение обладает шестью донорными атомами кислорода и двумя атомами азота, благодаря чему оно может связываться с металлическими ионами в различных координационных числах и валентностях. Это дает возможность использовать ЭДТА для титрования металлов и определения их концентраций в различных растворах.
Как и любое химическое вещество, молекула ЭДТА имеет свои недостатки. Одним из них является ее высокая стоимость и сложность синтеза. Кроме того, ЭДТА является токсичной вещью, требующей соблюдения мер предосторожности при обращении с ней. Однако, при правильном использовании и учете данных факторов, применение ЭДТА в аналитической и других областях является эффективным инструментом для получения стабильных и точных результатов.
Таким образом, молекула ЭДТА обладает рядом преимуществ и недостатков в своем применении. Ее высокая дентатность и способность образовывать хелаты с металлами делают ее незаменимым соединением в аналитической химии, медицине и пищевой промышленности. В то же время, высокая стоимость и токсичность требуют особой осторожности при работе с ней. В целом, использование ЭДТА является эффективным методом для получения точных и надежных результатов при проведении химических исследований.
Вопрос-ответ

Какова максимальная дентатность молекулы ЭДТА?
Молекула ЭДТА имеет максимальную дентатность 6, что означает, что она может образовывать комплексы с металлами, занимая все шесть координатных позиций металлического иона.
Какие металлы могут образовывать хелаты с молекулой ЭДТА?
Молекула ЭДТА способна образовывать хелаты с большим количеством металлов, включая ионы меди, никеля, цинка, марганца, железа, алюминия и многие другие. Это связано с высокой способностью ЭДТА к образованию координационных связей и его универсальностью в образовании комплексов с различными металлами.
