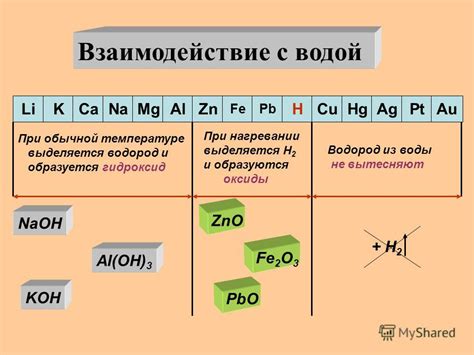
Взаимодействие металлов с водой является важным процессом, который приводит к формированию различных реакционно-способных соединений. Одной из наиболее распространенных реакций является окисление металла при взаимодействии с кислородом воды, что приводит к образованию оксида металла.
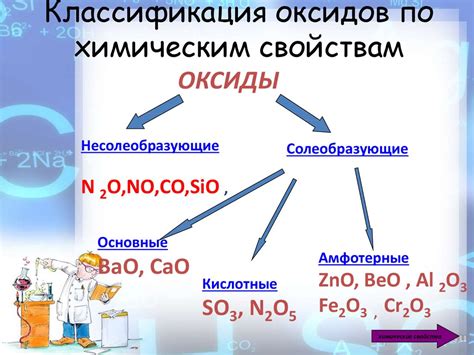
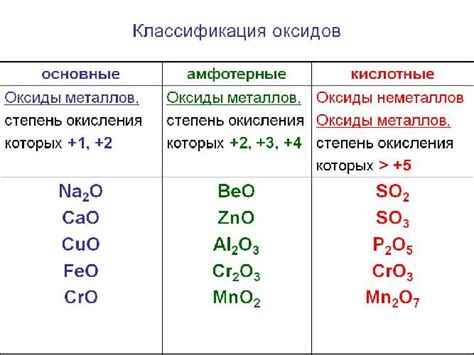
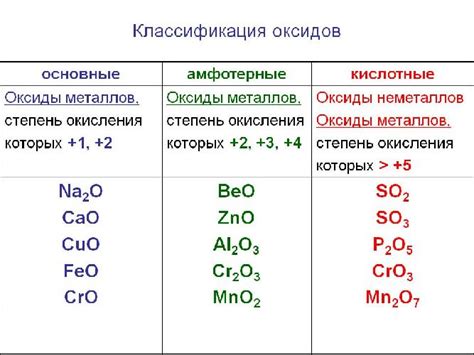
Оксиды металлов при взаимодействии с водой обладают различными свойствами и находят широкое применение в различных областях науки и промышленности. Некоторые оксиды обладают высокими кислотными свойствами и могут использоваться в качестве катализаторов реакций окисления. Другие оксиды имеют основные свойства и используются в производстве стекла и керамики. Еще другие оксиды обладают семикондуктивными свойствами и применяются в производстве полупроводниковых устройств.
Металлы, образующие оксиды при взаимодействии с водой, включают алюминий, железо, магний, натрий, калий и другие. Важно отметить, что их реакция с водой может протекать с различной интенсивностью и сопровождаться выделением тепла или газов. Например, взаимодействие некоторых металлов с водой происходит медленно, без видимого выделения газов, в то время как другие металлы реагируют с водой с большой энергичностью, сопровождаясь выделением гидрогена и образованием горячих паров.
Металлы в контакте с водой: оксиды в процессе реакции
Многие металлы реагируют с водой, образуя оксиды. Реакция между металлом и водой может быть экзотермической и сопровождаться выделением тепла и выходом водорода. Оксиды, образующиеся в процессе реакции, играют важную роль в промышленности и повседневной жизни.
Одним из примеров такой реакции является реакция натрия с водой. При контакте натрия с водой происходит интенсивное шипение и выброс искр. В результате реакции образуется оксид натрия (Na2O). Оксид натрия, или натриевая известь, широко используется в производстве стекла, мыла, моющих средств и других химических продуктов.
Еще одним примером реакции металла с водой является реакция железа с водой. При контакте железа с водой происходит образование гидроксида железа (Fe(OH)2), который окисляется в оксид железа (Fe2O3). Оксид железа, или ржавчина, является одним из наиболее распространенных оксидов в окружающей среде.
Также металлы, такие как алюминий, магний, цинк, реагируют с водой, образуя соответствующие оксиды. Реакции этих металлов с водой часто используются в различных химических процессах и промышленности. Например, оксид магния (MgO) широко используется в производстве огнеупорных материалов и добавок в косметические средства.
Таким образом, контакт металлов с водой приводит к образованию оксидов, которые находят широкое применение в различных отраслях промышленности и повседневной жизни.
Металлы и оксиды: взаимосвязь и важность
Металлы, как активные химические элементы, имеют способность взаимодействовать с водой и образовывать оксиды. Оксиды металлов являются важными веществами и играют значительную роль в различных отраслях промышленности и науки.
Взаимодействие металлов с водой происходит посредством окисления, когда металл отдает электроны, а их получает вода. В результате этой реакции образуется оксид металла и высвобождается водород. Оксиды металлов имеют различные свойства и в зависимости от них могут быть применены в разных отраслях.
Оксиды металлов широко используются в производстве керамики, стекла, электроники, катализаторов и других материалов. Они обладают различными свойствами, такими как прочность, термостойкость, проводимость, кислото- или щелочность, благодаря которым находят свое применение в разных областях.
Некоторые оксиды металлов обладают важными свойствами, такими как антибактериальная активность или светоизлучающие способности, что делает их незаменимыми в медицине и оптоэлектронике. Важно отметить, что некоторые оксиды металлов, попадая в окружающую среду, могут быть токсичными и иметь негативное влияние на организм человека и окружающую среду.
Таким образом, взаимосвязь между металлами и оксидами является важной для различных областей промышленности и науки, обеспечивая широкий спектр материалов с разнообразными свойствами и функциональностью.
Реакция металлов с водой: образование оксидов

Многие металлы обладают способностью взаимодействовать с водой и образовывать оксиды. При этом, химическая реакция между металлом и водой может протекать различными способами и иметь разную интенсивность.
Некоторые металлы, такие как калий (K), натрий (Na) и литий (Li), очень активны и реагируют с водой с выделением газа водорода (H2). При этом образуется щелочная среда и оксид металла. Такая реакция происходит очень быстро и с высокой интенсивностью.
Другие металлы, например, железо (Fe), цинк (Zn) и алюминий (Al), взаимодействуют с водой гораздо медленнее. В результате реакции образуются соответствующие оксиды, а также выделяется водород. Однако интенсивность этой реакции намного ниже, поэтому она протекает более медленно.
Также существуют металлы, которые практически не реагируют с водой. Например, серебро (Ag) и платина (Pt) остаются стабильными при контакте с водой и не проявляют химической активности. Такие металлы не образуют оксиды при взаимодействии с водой и не выделяют водород.
Важно отметить, что реакция металлов с водой может быть использована при различных химических процессах и в технологических целях. Например, этот принцип лежит в основе работы горелок на газе, где происходит контролируемое взаимодействие металлических элементов с водой для образования свободного водорода, который потом сгорает и выделяет тепло.
Активные металлы и их оксиды: примеры
Одной из характерных свойств активных металлов является их способность образовывать оксиды при взаимодействии с водой. Оксиды активных металлов образуются в результате окисления металла при реакции с кислородом из воды.
Примером активного металла, образующего оксид при взаимодействии с водой, является натрий (Na). При контакте натрия с водой образуется оксид натрия (Na2O), который реагирует с водой и образует щелочную соль натрия гидроксид (NaOH).
Еще один пример активного металла – калий (K). При взаимодействии калия с водой образуется оксид калия (K2O), который далее реагирует с водой, образуя гидроксид калия (KOH) – щелочную соль.
Также стоит отметить магний (Mg), который тоже является активным металлом и образует оксид при реакции с водой. Оксид магния (MgO) реагирует с водой и образует гидроксид магния (Mg(OH)2).
Есть и другие активные металлы, образующие оксиды при взаимодействии с водой, такие как кальций (Ca), стронций (Sr), барий (Ba) и другие. Итоговые оксиды реагируют с водой и образуют соответствующие гидроксиды – щелочные соли.
Пассивные металлы и их оксиды: особенности
Пассивные металлы - это те, которые обладают способностью образовывать плотную и стойкую пассивную оксидную пленку на поверхности при взаимодействии с водой или другими окисляющими веществами. Такая пленка играет важную роль в защите металла от окисления и коррозии.
Наиболее известными пассивными металлами являются нержавеющие стали. Они содержат хром, который образует устойчивую пассивную оксидную пленку, состоящую в основном из хромового оксида. Эта пленка защищает основной металл от передачи кислорода и влаги и предотвращает появление коррозии.
Пассивные оксиды обладают специфическими свойствами. Они могут быть очень твердыми и прочными, что значительно повышает стойкость металла к абразивному износу. Кроме того, пассивные оксиды имеют низкую склонность к разрушению в кислотных средах, что обеспечивает долговечность и надежность металлических конструкций.
Из-за наличия пассивной оксидной пленки, пассивные металлы имеют широкий диапазон применения. Их можно использовать в различных отраслях промышленности, включая химическую, пищевую, медицинскую и судостроительную. Кроме того, пассивные металлы нашли применение в производстве украшений и бытовых предметов, благодаря своей привлекательной внешности и стойкости к внешнему воздействию.
Оксиды металлов: сферы применения
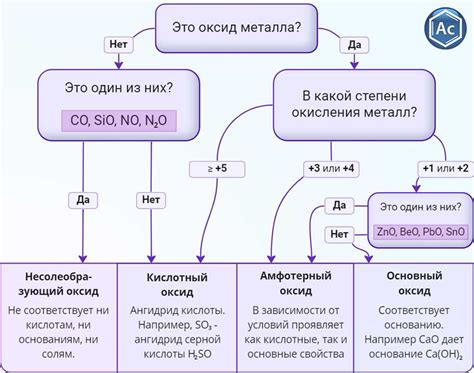
Оксиды металлов широко используются в различных сферах человеческой деятельности. Они являются важными компонентами в производстве керамики и стекла. Многие оксиды, такие как оксид железа и оксид алюминия, обладают высокой теплоустойчивостью и стойкостью к химическим воздействиям, что делает их идеальными для использования в качестве материалов для изготовления посуды, керамических изделий и огнеупорных материалов.
Оксиды металлов также широко применяются в электротехнической промышленности. Например, оксид цинка используется в производстве пьезоэлектрических датчиков и аккумуляторов, а оксид кадмия применяется в производстве солнечных батарей и электронных устройств.
Другой сферой применения оксидов металлов является строительная отрасль. Оксиды таких металлов, как оксид кальция и оксид магния, используются в производстве строительных материалов, таких как цемент и штукатурка. Они добавляются к смесям для придания им прочности и устойчивости к воздействию влаги и агрессивных веществ.
Это лишь некоторые из сфер, в которых широко используются оксиды металлов. Благодаря своим уникальным физическим и химическим свойствам, эти соединения нашли свое применение во многих областях, где требуется высокая стойкость к экстремальным условиям, электропроводность или прочность материала.
Вопрос-ответ

Какие металлы реагируют с водой и образуют оксиды?
Реакцию с водой и образование оксидов обычно проявляют щелочные металлы, такие как натрий (Na) и калий (K), а также щелочноземельные металлы, такие как магний (Mg) и кальций (Ca).
Что происходит при реакции металла с водой?
При реакции металла с водой верхний слой металла окисляется, образуя оксид металла, а молекулы воды разлагаются на водород (H2) и гидроксид металла (NaOH, KOH и т.д.).
