Металлы второй группы главной подгруппы включают в себя металлы такие как магний, цинк, кадмий и ртуть. Они имеют ряд уникальных физических свойств, которые делают их полезными и востребованными в различных отраслях промышленности и научных исследованиях.
Одним из характерных физических свойств данных металлов является их низкая плотность. Магний, например, является самым легким из конструкционных металлов и имеет плотность всего 1,74 г/см³. Это делает его идеальным материалом для использования в авиационной промышленности, где вес является критическим фактором.
Кроме того, металлы второй группы обладают высокой теплопроводностью и электропроводностью. Например, цинк является отличным электропроводником и широко используется в производстве батареек и электронных устройств. Кадмий, в свою очередь, обладает высокой теплоотдачей и используется в конструкции радиаторов и теплообменных устройств.
Кроме указанных свойств, металлы второй группы обладают высокой пластичностью и хорошими механическими свойствами. Это позволяет им быть прочными и легкими в обработке. Они образуют стойкие соединения с другими металлами и легкими элементами, что делает их ценными в производстве сплавов и материалов для различных целей.
Металлы второй группы главной подгруппы: общие свойства
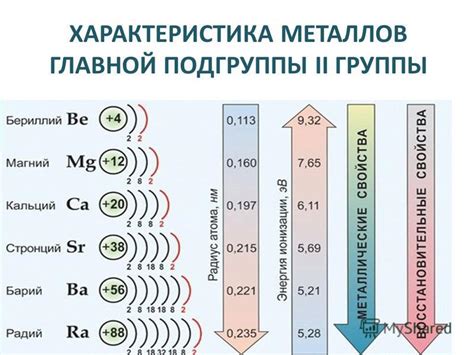
Металлы второй группы главной подгруппы – это элементы, которые находятся во второй колонке периодической системы элементов. Эта группа включает бериллий, магний, кальций, стронций, барий и радий. Все эти элементы являются металлами и обладают рядом общих физических свойств.
Во-первых, металлы второй группы главной подгруппы характеризуются высокой электропроводностью. Их электроны свободно перемещаются по кристаллической решетке металла, что делает их отличными проводниками электричества.
Во-вторых, металлы этой группы обладают высоким температурным расширением. Они увеличивают свой объем при нагреве и сокращаются при охлаждении. Это свойство имеет практическое применение при разработке различных механизмов и конструкций.
Кроме того, металлы второй группы главной подгруппы имеют высокую плотность. Их атомы плотно упакованы, что обуславливает их тяжесть и прочность. Благодаря этим свойствам металлы этой группы широко используются в строительстве, машиностроении и других отраслях промышленности.
В целом, металлы второй группы главной подгруппы обладают рядом полезных свойств, которые делают их незаменимыми в различных областях человеческой деятельности. Их высокая электропроводность, термическое расширение и плотность позволяют им выполнять разнообразные функции, от проводников электричества до структурных элементов конструкций.
Плотность, твердость и плавление
Металлы второй группы главной подгруппы – цинк, кадмий и ртуть – обладают различными физическими свойствами, включая плотность, твердость и температуру плавления.
Плотность – это физическая величина, которая характеризует массу вещества, заключенную в единице объема. Цинк имеет плотность около 7 г/см³, тогда как кадмий имеет плотность около 8,65 г/см³. Ртуть же является исключением – ее плотность составляет около 13,6 г/см³, что делает ее одним из самых плотных элементов.
Твердость – это свойство материала сопротивляться поверхностным деформациям при нагрузке. Цинк и кадмий относительно мягкие металлы: их показатель твердости составляет примерно 2,5 по шкале Мооса. Ртуть же является жидким металлом при комнатной температуре, поэтому понятие твердости для нее не применимо.
Температура плавления – это температура, при которой физическое состояние вещества изменяется с твердого на жидкое. Цинк плавится при температуре около 420°C, кадмий – при температуре около 321°C. Ртуть является жидким металлом при комнатной температуре, поэтому для нее понятие температуры плавления не имеет смысла.
Электропроводность и теплопроводность
Металлы второй группы главной подгруппы имеют высокую электропроводность и теплопроводность. Эти свойства обусловлены особенностями строения атомов и кристаллической решетки металлической структуры.
Атомы металлов второй группы главной подгруппы имеют низкую электроотрицательность, что способствует образованию свободных электронов. Эти свободные электроны движутся по металлической структуре, образуя так называемое "электронное облако". Именно благодаря этим свободным электронам металлы обладают высокой электропроводностью. Силы притяжения электронов к положительно заряженным ядрам атомов очень слабы, поэтому электроны могут свободно передвигаться и переносить электрический ток.
Теплопроводность металлов второй группы главной подгруппы также обусловлена наличием свободных электронов и плотной упаковкой атомов. Свободные электроны переносят тепловую энергию, передавая её от атома к атому. Кроме того, кристаллическая решетка металлов обеспечивает эффективное распространение тепла. Межатомные связи в металлах слабые, поэтому атомы могут легко передавать тепловую энергию друг другу.
Высокая электропроводность и теплопроводность делают металлы второй группы главной подгруппы важными материалами для различных областей промышленности и науки. Они используются, например, в производстве проводов и кабелей, электронных компонентов, теплообменных аппаратах и других устройствах, где требуется эффективная передача электрического тока и тепловой энергии.
Химическая активность и реакции с кислородом

Металлы группы II главной подгруппы обладают высокой химической активностью, особенно в реакциях с кислородом. Они имеют довольно низкие потенциалы окисления, что означает, что они легко отдавают свои электроны. Как результат, эти металлы имеют тенденцию образовывать оксиды при взаимодействии с кислородом.
Наиболее известным примером этой реакции является образование оксида магния (MgO), когда магний реагирует с кислородом. Эта реакция сопровождается выделением тепла и образованием белого порошка оксида. Оксид магния имеет высокую температуру плавления и широко используется в производстве огнеупорных материалов и керамики.
В присутствии влаги или кислорода, металлы группы II главной подгруппы могут также реагировать с водой, образуя гидроксиды. Например, магний, реагируя с водой, образует гидроксид магния (Mg(OH)2) и выделяет водород. Эта реакция является химической реакцией окисления-восстановления, где магний окисляется, отдавая электроны, а вода восстанавливается, получая электроны.
Однако, следует отметить, что реактивность металлов группы II главной подгруппы с кислородом увеличивается с увеличением атомной массы. Например, бериллий, наименее реакционноспособный металл этой группы, практически не образует оксиды при реакции с кислородом. Величина реактивности от магния (более реакционноспособный) до бария (самый реакционноспособный) является результатом изменения атомных свойств и электронной структуры металлов в этой группе.
Вопрос-ответ

Какие свойства металлов второй группы главной подгруппы можно отнести к физическим?
К физическим свойствам металлов второй группы главной подгруппы относятся: высокая плотность, высокая теплопроводность, высокая электропроводность, низкая температура плавления и высокая твердость.
Что такое плотность металлов второй группы главной подгруппы?
Плотность металлов второй группы главной подгруппы — это физическая характеристика, которая обозначает массу данного вещества в единице объема. Металлы этой группы обладают высокой плотностью, что делает их тяжелыми и непрозрачными для света.
Какие примеры можно привести в качестве металлов второй группы главной подгруппы?
В металлах второй группы главной подгруппы можно выделить такие элементы, как магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Все эти металлы имеют сходные физические свойства и расположены в одной группе периодической системы.
