Галогены – это элементы VII группы периодической системы химических элементов, включающие в себя фтор, хлор, бром, йод и астат, которые относятся к неметаллам. У данных элементов характерной особенностью является высокая электроотрицательность, что обуславливает их активность при взаимодействии с металлами.
При взаимодействии галогенов с металлами образуются соли галогенидов металлов. Галогениды – это химические соединения, состоящие из анионов галогена (фторида, хлорида, бромида, йодида и астатида) и катионов металла. Образование солей галогенидов происходит в результате обменной реакции, при которой анион галогена замещает другой анион, находящийся в исходном соединении с металлом.
Образование галогенидов металлов является важным аспектом в химических реакциях и применяется в различных областях. Например, соли галогенидов металлов используются в фармацевтической промышленности, для получения различных химических соединений и материалов, а также в производстве электроники и каталитических реакций.
Взаимодействие галогенов с металлами

Взаимодействие галогенов с металлами - это процесс, при котором галогены (хлор, бром, йод) вступают в химическую реакцию с различными металлами. Такое взаимодействие имеет свои особенности и может приводить к образованию различных соединений.
Галогены обладают высокой электроотрицательностью, что делает их сильными окислителями в химических реакциях. Они могут отбирать электроны у металлических атомов, образуя ионные соединения. Образование ионов галогенов и ионов металлов является результатом такого взаимодействия.
При взаимодействии галогенов с металлами могут образовываться соли галогеновых кислот. Например, хлор может реагировать с натрием, образуя хлорид натрия (NaCl), который является одной из самых распространенных и известных солей. Также возможно образование других галогенидов металлов, например, бромидов или йодидов.
Взаимодействие галогенов с металлами может быть полезным для получения галогенидов металлов, которые широко используются в различных областях, включая химическую промышленность и лабораторные исследования. Кроме того, такие реакции имеют большое значение в химии и позволяют изучать реакционную способность галогенов и их взаимодействие с металлами.
Образование солей

При взаимодействии галогенов с металлами образуются соли, которые представляют собой химические соединения между металлом и галогеном. Соли обладают определенными физическими и химическими свойствами, которые зависят от ионной природы галогена и металла.
Образование солей происходит путем ионно-молекулярной реакции, при которой ионы металла и ионы галогена образуют ионную решетку. В этой решетке ионы металла занимают узлы, а ионы галогена располагаются между ними.
Соли имеют кристаллическую структуру и образуют кристаллы различной формы и цвета. Их физические свойства, такие как температура плавления, твердость и растворимость, могут сильно отличаться в зависимости от используемых галогена и металла.
Соли, образующиеся при взаимодействии галогенов с металлами, широко применяются в различных отраслях промышленности и научных исследованиях. Они используются в производстве химических реактивов, лекарственных препаратов, красителей, пищевых добавок и многих других продуктах.
Химические реакции

Химические реакции - это процессы, при которых происходит изменение состава вещества, сопровождающиеся образованием новых веществ.
Взаимодействие галогенов с металлами приводит к образованию солей. Галогены (фтор, хлор, бром, йод) являются характерными газообразными неметаллами, а металлы, такие как медь, железо, алюминий – это металлические элементы.
Если галогены реагируют с металлами, образуются ионы галогенида и ионы металла. При этом возможно образование различных галогенидов в зависимости от вида галогена и металла.
Например, в результате взаимодействия хлора с натрием образуется натрий хлорид (NaCl), который является хлоридом натрия и широко используется в пищевой и химической промышленности.
Также, при взаимодействии металла и галогена может происходить образование двойных галогенидов, которые состоят из двух различных галогенов и одного металла. Например, хлорид бромида алюминия (AlBrCl) образуется при взаимодействии хлора, брома и алюминия.
Химические реакции между галогенами и металлами имеют широкое применение в различных отраслях промышленности и науки, таких как производство органических соединений и полупроводниковых материалов, а также в качестве катализаторов в химических процессах.
Образование галогенидов
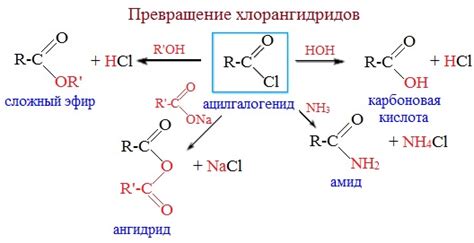
Галогениды - это соединения галогенов с металлами. Галогены, такие как фтор, хлор, бром и йод, образуют стабильные соединения с многими металлами. Образование галогенидов происходит при взаимодействии галогена с металлом в каких-то условиях.
В процессе образования галогенида металла происходит передача электронов между галогеном и металлом. Обычно галогены очень электроотрицательны, в то время как металлы обладают меньшей электроотрицательностью. Это позволяет галогену принимать электроны и образовывать отрицательные ионы, а металлу отдавать электроны и образовывать положительные ионы.
Галогениды имеют различные структуры и свойства в зависимости от состава и условий образования. Например, некоторые галогениды образуют кристаллическую решетку, в то время как другие могут быть аморфными или мономолекулярными соединениями. Некоторые галогениды обладают высокой степенью растворимости в воде, а другие плохо растворимы в неполярных растворителях.
Галогениды имеют широкое применение в различных областях. Например, некоторые галогениды используются в производстве солей, катализаторов, электролитических растворов, плавиков и других материалов. Галогениды также могут использоваться в медицине, фотографии, электронике и других отраслях науки и промышленности.
Использование галогенидов в промышленности

Галогениды – это соединения, образующиеся при взаимодействии галогенов с металлами. Они находят широкое применение в различных отраслях промышленности.
В химической промышленности галогениды используются как вещества для синтеза различных органических и неорганических соединений. Они являются важными промежуточными продуктами при производстве пластмасс, резин, красителей и многих других химических продуктов.
В электротехнической промышленности галогениды применяются как компоненты в ростверковых элементах и различных электролитах. Они обладают высокой электропроводностью, что позволяет использовать их в производстве конденсаторов и аккумуляторов. Кроме того, галогениды металлов также используются в электропроводящих пастах и паяльных материалах.
В металлургической промышленности галогениды широко используются для обработки и очистки металлов. Они применяются как флюсы, которые облегчают расплавление и удаление окислов при выплавке и отливке металлических изделий. Галогениды также используются в производстве алюминия и других металлов, а также для создания защитных покрытий на металлических поверхностях.
В фармацевтической промышленности галогениды применяются в процессе синтеза лекарственных веществ. Они могут использоваться в качестве катализаторов или реагентов при получении определенных органических соединений, которые обладают лекарственными свойствами.
В сельском хозяйстве галогениды применяются в производстве удобрений. Они могут входить в состав минеральных удобрений для обогащения почвы важными микроэлементами, которые необходимы для роста и развития растений.
Таким образом, галогениды являются важными компонентами в различных отраслях промышленности. Их уникальные свойства и широкое применение делают их неотъемлемой частью многих производственных процессов.
Влияние галогенидов на окружающую среду

Галогениды – химические соединения, состоящие из галогенов и металлов. Многие из них широко применяются в промышленности и быту, однако взаимодействие галогенидов с окружающей средой может иметь негативные последствия.
Одним из главных проблемных аспектов влияния галогенидов на окружающую среду является их токсичность. Некоторые галогениды, например, хлориды и бромиды некоторых металлов, могут быть ядовитыми и оказывать вредное воздействие на живые организмы. При попадании галогенидов в воду или почву они могут вызывать загрязнение и снижать качество питьевой воды и плодородие почвы.
Также важно отметить, что галогениды могут образовывать токсичные испарения или выбрасываться в атмосферу при неправильном хранении или использовании. Это может приводить к загрязнению воздуха и негативно влиять на здоровье людей и животных.
Другой проблемой влияния галогенидов на окружающую среду является их потенциал к разрушению озонового слоя. Некоторые галогениды, такие как хлорфторуглероды, могут вызывать разрушение молекул озона и увеличивать уровень ультрафиолетового излучения, что ведет к повышенному риску раковых заболеваний и других здоровью вредных последствий.
С целью минимизации негативного влияния галогенидов на окружающую среду необходимо соблюдать правила и меры безопасности при хранении, использовании и утилизации этих веществ. Также важно осуществлять контроль и мониторинг уровня загрязнения галогенидами в окружающей среде и принимать соответствующие меры по их предотвращению и устранению.
Вопрос-ответ

Какие вещества образуются при взаимодействии галогенов с металлами?
При взаимодействии галогенов (хлора, брома, иода) с металлами образуются соли галогеноводородных кислот, например, хлориды, бромиды и иодиды металлов.
Какие реакции происходят при взаимодействии галогенов с металлами?
При взаимодействии галогенов с металлами идут реакции окисления металла и образования солей галогеноводородных кислот. Например, хлор реагирует с натрием, образуя хлорид натрия и выделяя водородный газ.
Какие свойства имеют полученные соли галогеноводородных кислот?
Соли галогеноводородных кислот обладают характерными свойствами своих кислотных компонентов и свойствами металлов, от которых они образованы. Например, хлорид натрия - соль хлороводородной кислоты и натрия, является белым кристаллическим веществом, хорошо растворимым в воде и используется в пищевой и химической промышленности.
Какие могут быть применения для полученных солей галогеноводородных кислот?
Соли галогеноводородных кислот, полученные при взаимодействии галогенов с металлами, имеют широкое применение. Например, хлорид натрия используется в пищевой промышленности как консервант и приправа, бромид калия используется в медицине для лечения некоторых заболеваний, иодид свинца используется в фотографии.
Какие факторы могут влиять на ход реакции взаимодействия галогенов с металлами?
Ход реакции взаимодействия галогенов с металлами может зависеть от различных факторов, таких как температура, концентрация реагентов, физическая форма металла и наличие катализаторов. Например, повышение температуры может ускорить реакцию, а использование катализаторов может улучшить выход продукта.
