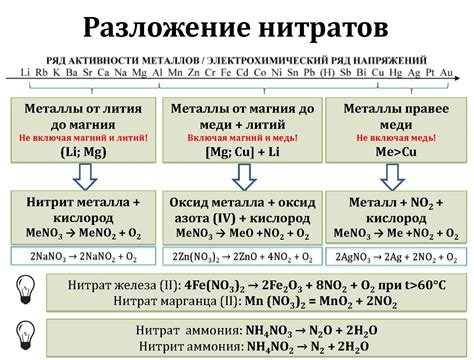
Разложение оксидов металлов при нагревании – важный процесс, который часто изучается в химии. Оксиды металлов – это соединения, в которых металл соединен с кислородом. При нагревании оксиды металлов могут разлагаться на металл и кислород. Такое разложение оксида металла может протекать в зависимости от различных факторов, таких как температура нагрева, свойства металла и оксида, а также наличие катализаторов.
Одним из примеров разложения оксида металла при нагревании является разложение оксида меди (II) (CuO). При нагревании CuO до определенной температуры происходит разложение оксида на медь и кислородный газ. Этот процесс можно представить следующим уравнением: CuO → Cu + O2. Температура разложения оксида меди зависит от его физических свойств и может быть определена экспериментально.
Еще одним примером разложения оксида металла при нагревании является разложение оксида свинца (II) (PbO). При нагревании PbO до определенной температуры происходит разложение оксида на свинец и кислородный газ. Уравнение этого процесса выглядит следующим образом: PbO → Pb + O2. Также как и в случае с разложением оксида меди, температура разложения оксида свинца зависит от его физических свойств и может быть определена экспериментально.
Общая информация о разложении оксидов металлов

Разложение оксидов металлов при нагревании является важным явлением в химии и находит широкое применение в различных областях. Оксиды металлов представляют собой химические соединения, состоящие из атомов металла и кислорода.
При нагревании оксиды металлов могут разлагаться на металл и кислородный газ. Это происходит благодаря тепловой декомпозиции, в результате которой происходит распад оксида на его составляющие элементы. Разложение оксидов металлов может происходить при различных температурах и зависит от химической природы металла.
Некоторые оксиды металлов разлагаются при относительно низких температурах, в то время как другие требуют воздействия высоких температур. Например, оксид железа (Fe2O3) разлагается при нагревании до температуры около 800 градусов Цельсия, в то время как оксид алюминия (Al2O3) разлагается при температуре около 2050 градусов Цельсия.
Разложение оксидов металлов при нагревании имеет широкое применение в различных технологических процессах. Например, разложение оксида свинца (PbO) используется для получения свинца, а разложение оксида железа (Fe3O4) - для получения железа в промышленных масштабах.
Также разложение оксидов металлов при нагревании может быть использовано для получения кислорода. Например, оксид меди (CuO) может быть разложен при нагревании до высоких температур для получения кислорода, который может быть использован в различных процессах, включая сжигание топлива и поддержание жизни в закрытых пространствах.
Разложение оксида железа
Оксид железа, также известный как ржавчина, может разлагаться при нагревании, превращаясь обратно в металлическое железо. Этот процесс, известный как восстановление, является важной реакцией, применяемой в промышленности и в химических лабораториях.
При нагревании оксида железа (Fe2O3) до высоких температур происходит его разложение. Наиболее распространенный и простой способ разложения оксида железа - это его нагревание с помощью открытого пламени газовой горелки или путем нагревания на металлической поверхности.
В результате разложения оксида железа образуется металлическое железо (Fe) и кислород (O2). Реакция разложения оксида железа может быть представлена следующим уравнением:
2Fe2O3 -> 4Fe + 3O2
Это уравнение описывает стехиометрическое соотношение между оксидом железа и продуктами его разложения. При нагревании оксида железа до достаточно высоких температур, разложение может произойти полностью, приводя к образованию только металлического железа и кислорода.
Разложение оксида железа является одной из фундаментальных реакций в химии и имеет широкое применение в различных областях, включая металлургию, производство стали и химическую синтез. Понимание механизма и условий разложения оксида железа важно для оптимизации процессов, связанных с его использованием.
Разложение оксида меди

Оксид меди (II) CuO является одним из самых распространенных оксидов меди. При нагревании он разлагается на два элемента: медь (Cu) и кислород (O). Этот процесс происходит при достаточно высоких температурах, в зависимости от условий разложения.
При нагревании оксида меди можно наблюдать появление характерного красно-коричневого покрытия на поверхности вещества. Это является признаком разложения оксида меди и образования свежей меди. Если процесс разложения проводится в закрытой среде, то большая часть образовавшейся меди остается в виде пыли на стенках реакционного сосуда.
Разложение оксида меди происходит при температуре около 400–600 °C. При этом образуется газообразный кислород и твердая медь, которая может быть собрана и использована в дальнейших химических реакциях. Оксид меди широко применяется в различных химических процессах и обладает множеством полезных свойств.
Таким образом, разложение оксида меди при нагревании является важным процессом, который может быть использован в различных химических реакциях и производствах.
Разложение оксида цинка

Разложение оксида цинка - это химическая реакция, при которой твердое вещество оксид цинка распадается на более простые вещества при нагревании. Оксид цинка (ZnO) имеет формулу Zn + O2 и обладает белым цветом.
При нагревании оксида цинка до температур около 1000 градусов Цельсия, он распадается на элементарный цинк (Zn) и молекулярный кислород (O2). Реакция разложения оксида цинка является экзотермической, то есть сопровождается выделением тепла.
Уравнение химической реакции разложения оксида цинка выглядит следующим образом:
ZnO → Zn + 1/2O2
При нагревании оксида цинка до высоких температур в присутствии катализаторов, таких как алюминий (Al), происходит еще более интенсивное разложение оксида цинка.
Разложение оксида цинка имеет практическое применение, например, в промышленности при получении цинкового металла. Оксид цинка, полученный из руды, подвергается нагреванию для получения элементарного цинка, который используется во многих отраслях промышленности, включая производство автомобилей, батареек и сплавов.
Разложение оксида свинца

Оксид свинца (II) (PbO) при нагревании разлагается на металлический свинец и кислородный газ. Такой процесс разложения называют термическим.
Реакция разложения оксида свинца обычно проводится в вакууме или в атмосфере инертного газа, чтобы предотвратить окисление разлагающегося свинца кислородом из воздуха.
Разложение PbO можно представить следующим уравнением реакции:
2PbO → 2Pb + O2
При нормальных условиях оксид свинца является желтовато-коричневым порошком. В процессе разложения он плавится и превращается в металлический свинец, который имеет серебристо-серый цвет.
Разложение оксида свинца может быть использовано в промышленности для получения металлического свинца, а также в лабораторных условиях для проведения экспериментов и исследований свойств веществ.
Разложение оксида алюминия

Оксид алюминия (Al2O3) является одним из наиболее распространенных оксидов металлов. При нагревании оксид алюминия происходит его разложение на металлический алюминий и кислород.
Разложение оксида алюминия можно представить следующей реакцией:
2Al2O3 → 4Al + 3O2
При этом оксид алюминия претерпевает превращение из твёрдого вещества в газообразное вещество. Разложение оксида алюминия является экзотермическим процессом, то есть происходит с выделением тепла.
Разложение оксида алюминия при нагревании может быть использовано для получения металлического алюминия. Такой процесс называется алюминотермией и применяется в промышленности для производства алюминия и его сплавов. Алюминотермический процесс имеет высокую энергетическую эффективность и широко применяется в металлургии и других отраслях промышленности.
Вопрос-ответ

Какие оксиды металлов разлагаются при нагревании?
При нагревании разлагаются различные оксиды металлов, в зависимости от химической природы металла. Оксиды таких металлов, как медь (Cu), железо (Fe), свинец (Pb), олово (Sn), бериллий (Be) и некоторые другие, разлагаются при нагревании.
Почему оксиды металлов разлагаются при нагревании?
Разложение оксидов металлов при нагревании происходит из-за способности металлов к окислению. При нагревании окислительная способность металла возрастает, что приводит к разложению его оксида на металл и кислород.
Какой механизм разложения оксидов металлов при нагревании?
Механизм разложения оксидов металлов при нагревании может быть различным. Например, при разложении оксида железа (FeO) металл Fe образуется за счет реакции с водородом, а при разложении оксида меди (CuO) металл Cu образуется путем реакции с углеродом.
Какие еще факторы могут влиять на разложение оксидов металлов при нагревании, кроме химической природы металла?
Помимо химической природы металла, разложение оксидов металлов при нагревании может зависеть от таких факторов, как температура нагревания, давление, наличие катализаторов и окружающая среда. Например, некоторые оксиды металлов могут разлагаться только в присутствии кислорода.
