Сероводород (H2S) – это химическое соединение, состоящее из двух атомов водорода и одного атома серы. Оно является газообразным веществом с резким запахом, характерным для гниющих яиц или гнилости.
Сероводород взаимодействует с разными металлами, образуя различные химические соединения. При этом могут происходить как окислительные, так и восстановительные реакции.
Металлы группы переходных элементов часто образуют со сероводородом стабильные соединения, такие как сульфиды. Эти соединения обладают различными свойствами, включая магнитные, полупроводниковые и катализирующие свойства.
Например, никель (Ni) образует никелиевый сульфид (NiS), который может использоваться в качестве катализатора при различных химических реакциях. Медь (Cu) взаимодействует с сероводородом, образующим медный сульфид (CuS), который часто применяется в производстве электродов и полупроводников.
Металлы щелочных и щелочноземельных элементов также могут реагировать с сероводородом. Например, натрий (Na) образует сернокислый натрий (NaHS), который может использоваться в качестве источника сероводорода в различных процессах.
В общем, взаимодействие сероводорода с металлами – это сложный процесс, который может приводить к образованию различных соединений с разными свойствами. Знание этих реакций и свойств соединений может быть полезно в различных областях, включая химическую промышленность, электронику и катализаторные процессы.
Химические свойства сероводорода

Сероводород – это химическое соединение, обладающее рядом уникальных свойств и способностей, которые определяют его роль во многих химических реакциях.
Сероводород является одним из самых ядовитых веществ, известных человечеству. Он обладает резким и характерным запахом, похожим на запах гниения яиц, который человек может почувствовать уже при очень низкой концентрации в воздухе. Это объясняется тем, что сероводород образуется при разложении органических веществ, содержащих серу.
Сероводород обладает кислотными свойствами, поэтому может реагировать с различными базами и основаниями. Он способен образовывать соли, которые могут быть катализаторами реакций.
Также сероводород может окисляться до элементарной серы и воды в кислородной среде, при этом выделяется большое количество тепла. Это позволяет использовать сероводород в качестве высокоэффективного топлива для промышленных процессов.
Некоторые металлы могут реагировать с сероводородом, образуя соединения, которые широко применяются в различных отраслях промышленности. Например, при взаимодействии сероводорода с железом образуется сульфид железа (II), который используется в производстве ферромагнитных материалов.
Реакции сероводорода с металлами

Сероводород - это безцветный газ с характерным запахом, который имеет сильные реакционные свойства при взаимодействии с металлами. Реакции сероводорода с металлами могут протекать по различным сценариям в зависимости от химических свойств металла и условий реакции.
Сероводород может реагировать с некоторыми металлами, образуя сульфиды. Например, взаимодействие сероводорода с железом приводит к образованию черного сульфида железа (FeS). Эта реакция часто наблюдается при образовании серогрязевых осадков в водных системах, содержащих растворенные соли железа и сероводород.
Реакции сероводорода с другими металлами могут быть более сложными и разнообразными. Например, при взаимодействии сероводорода с медью могут образовываться сульфиды меди различной степени окисления, такие как CuS и Cu2S. Эти соединения обладают различными свойствами и могут иметь различный цвет и физическую форму.
Реакции сероводорода с металлами могут происходить при присутствии воды или без нее. Во влажной атмосфере сероводород может вызывать коррозию металлических поверхностей, образуя сульфидные отложения. Это особенно заметно на поверхности медных и серебряных изделий, которые темнеют и покрываются сероводородными пятнами.
В целом, реакции сероводорода с металлами следует учитывать при эксплуатации металлических конструкций и оборудования в условиях, где возможно взаимодействие с сероводородом. Это позволит предотвратить возникновение коррозии и сохранить долговечность металлических изделий.
Взаимодействие сероводорода с железом

Сероводород является химическим соединением, обладающим высокой активностью и токсичностью. Взаимодействие сероводорода с железом является важным аспектом в химии и технологии.
При контакте сероводорода с железом происходит реакция, в результате которой образуются сероводородные соединения. Сероводород может образовывать серных соединений с железом, таких как сульфид железа (FeS) или пирит (FeS2).
Взаимодействие сероводорода с железом может приводить к коррозии металла. В результате образуются слои сернистых соединений, которые нарушают целостность поверхности железа и ухудшают его механические свойства.
Однако железо также может использоваться в качестве сорбента для очистки сероводородсодержащих газов. Железо способно вступать в реакцию с сероводородом, образуя при этом сульфиды. Эта реакция может быть использована для удаления сероводорода из промышленных газов или шахтных воздухов.
Окисление сероводорода металлами

Сероводород (H2S) является химическим соединением, имеющим ряд интересных свойств при взаимодействии с металлами. Одним из таких является окисление сероводорода металлами.
Окисление сероводорода металлами происходит при взаимодействии сероводорода с поверхностью металла в присутствии кислорода. В результате этой реакции образуются металлические сульфиды и вода. Например, при окислении сероводорода железом получается сернистый гидрогенид железа (FeS), который обладает специфическим запахом гнилой яйцами.
За частые примеры окисления сероводорода металлами можно привести реакцию между сероводородом и медью. При этом образуется медный сульфид (CuS), который обладает темно-черным цветом. Аналогичный процесс происходит с серебром, платиной и другими металлами.
Окисление сероводорода металлами является важным процессом в различных промышленных и химических сферах. Например, окисление сероводорода металлами используется в производстве сульфидного пигмента для окраски керамики и стекла, а также в производстве сульфидных катализаторов для различных химических реакций.
Таким образом, окисление сероводорода металлами является важным и интересным явлением, которое имеет широкое применение в различных сферах деятельности.
Сероводород и его роль в гальванических элементах
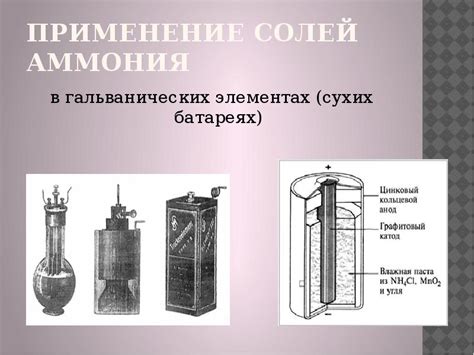
Сероводород (H2S) – это бесцветный горючий газ с яйцеподобным запахом, содержащий серу и водород. Он имеет широкий спектр применений, включая его использование в гальванических элементах.
В гальванических элементах сероводород может выполнять две основные роли. Во-первых, он может использоваться в качестве активатора электродных реакций. При непосредственном контакте с металлическими поверхностями сероводород активирует электронные переходы, что обеспечивает возникновение и поддержание электрического тока.
Во-вторых, сероводород может использоваться для защиты металлов от коррозии. Благодаря своим редуцирующим свойствам сероводород препятствует окислительной химической реакции, которая ведет к образованию коррозионных отложений на поверхности металла. Это особенно важно для металлических компонентов, подверженных воздействию агрессивных внешних условий или агрессивной среды.
В целом, использование сероводорода в гальванических элементах позволяет обеспечить эффективную работу и продлить срок службы металлических деталей и устройств. Он активирует электродные реакции, обеспечивая генерацию и передачу электрического тока, а также защищает металлы от коррозии, сохраняя их в рабочем состоянии.
Продукты реакции сероводорода с различными металлами

Сероводород (H2S) является химическим соединением, которое может взаимодействовать с различными металлами, образуя разнообразные продукты реакции. В результате реакции сероводорода с металлами образуются сульфиды металлов.
Взаимодействие сероводорода с катионами металлов обычно приводит к образованию осадков сернокислого металла. Например, при взаимодействии сероводорода с катионами железа(III) образуется осадок темно-коричневого цвета - осадок сернокислого железа (Fe2(SO4)3).
Сероводород также может отшелушивать оксидные пленки с поверхности различных металлов. При этом образуются темные слои сульфидов металлов, которые проявляются в виде пятен или коррозии на поверхности металлических изделий.
Сероводород может образовывать стабильные и растворимые соединения с такими металлами, как свинец, медь и цинк. Например, при реакции сероводорода с хлоридом свинца образуется темно-коричневый осадок сульфида свинца (PbS).
Кроме того, взаимодействие сероводорода с некоторыми металлами может приводить к образованию токсичных соединений. Например, при взаимодействии сероводорода с ртутью образуется темно-коричневый осадок сульфида ртути (HgS), который является тяжелым металлом и ядовитым веществом.
Свойства соединений сероводорода с металлами

1. Образование солей
Сероводород, реагируя с металлами, образует соединения - соли, которые характеризуются особыми свойствами. Эти соединения имеют место в присутствии кислорода или других окислителей.
2. Кислотные свойства
Соединения сероводорода с металлами обладают кислотными свойствами. Они растворяются в воде, образуя кислые растворы. При этом сероводород выделяется в виде газа. Кислотные свойства указывают на наличие положительно заряженных ионов металла в соединении.
3. Реакция с кислородом
Сероводород реагирует с кислородом при нагревании. В результате образуется сера и вода. Реакция происходит в присутствии металлов, которые могут служить катализаторами данной реакции.
4. Окислительные свойства
Соединения сероводорода с металлами обладают окислительными свойствами. Они способны передавать электроны другим веществам, в результате чего сами восстанавливаются. Окислительные свойства особенно активны в присутствии сильных окислителей.
5. Способность к образованию соединений с пирамидальной структурой
Соединения сероводорода с металлами формируют пирамидальную структуру, в которой сера находится в вершине, а металлы - в основании. Пирамидальная структура обеспечивает устойчивость соединений и их особые свойства.
Биологическая роль сероводорода в металлопротеинах
Сероводород является ключевым компонентом в металлопротеинах. Он играет важную роль в реакциях, связанных с переносом электронов, известных как реакции редокс, а также в катализе химических превращений.
Одним из наиболее известных примеров металлопротеинов, где сероводород играет важную роль, являются серную редуцирующие ферменты. Они способны превращать серу, содержащуюся в различных соединениях, в сероводород. Этот процесс важен для биологического цикла серы и участвует в образовании серы в природе.
Другим примером металлопротеинов, где сероводород играет ключевую роль, являются нитрильазы. Они катализируют гидролиз нитрилов, образуя сероводород и соответствующие карбоновые кислоты. Этот процесс не только участвует в образовании необходимых органических кислот, но и способствует элиминации токсичных нитрилов из организма.
Кроме того, сероводород является важной частью металлосенсорных белков, которые способны связывать различные металлы и реагировать на их присутствие в окружающей среде. Такие белки играют ключевую роль в регуляции уровня металлов в организмах и могут влиять на метаболические процессы.
В целом, роль сероводорода в металлопротеинах демонстрирует его важность для биологических процессов, связанных с превращением и переносом электронов, регуляцией уровня металлов и образованием необходимых органических соединений.
Вопрос-ответ

Каковы химические свойства сероводорода?
Сероводород - это химическое соединение серы и водорода. Оно обладает рядом характерных свойств, таких как ярко выраженный запах, ядовитость, легкость воспламенения, способность быть растворенным в водах и других органических растворителях.
Как взаимодействует сероводород с металлами?
Сероводород может реагировать с различными металлами, образуя соединения, которые могут быть как газообразными (например, сульфидами металлов), так и твердыми (например, свинцовым сульфидом). Во время реакции сероводород окисляется, а металлы восстанавливаются.
Какие металлы реагируют с сероводородом?
Некоторые металлы, такие как железо, никель, свинец и медь, могут реагировать с сероводородом, образуя сульфиды этих металлов. Однако не все металлы образуют стабильные соединения с сероводородом, и реактивность разных металлов может отличаться.
Какие химические реакции происходят при взаимодействии сероводорода с металлами?
Взаимодействие сероводорода с металлами может привести к образованию различных соединений, таких как сульфиды, пентасульфиды и полисульфиды. Например, реакция металла с сероводородом может привести к образованию металлического сульфида и выделению водорода. Также металлический сульфид может быть окислен до соответствующего оксида при взаимодействии с кислородом.
Какова роль сероводорода в промышленных процессах?
Сероводород играет значительную роль в промышленных процессах, таких как производство удобрений, производство серной кислоты и извлечение металлов из их руд. Он используется в качестве водородсодержащего газа при производстве различных химических соединений. Однако его использование также сопряжено с опасностью, так как сероводород ядовит и может быть взрывоопасным.
