Взаимодействие карбоната металла с кислотой - это процесс, в результате которого образуется соль, вода и выделение углекислого газа. Карбонаты металлов являются основными соединениями, которые могут реагировать с кислотами, образуя новые вещества и сопровождаясь различными химическими реакциями.
В зависимости от свойств карбоната металла и кислоты, процесс взаимодействия может происходить с различной интенсивностью и проявляться в виде разных химических реакций. Например, если металл является активным, то реакция может происходить достаточно интенсивно, с выделением большого количества углекислого газа и тепла. Если же металл является менее активным, то реакция может протекать медленнее и быть менее заметной.
Важным аспектом при взаимодействии карбоната металла с кислотой является буферное действие, которое может оказывать углекислота, образованная в результате реакции. Углекислота способна нейтрализовать избыток кислоты или щелочи, поддерживая оптимальный уровень pH в реакционной среде. Это свойство делает взаимодействие карбонатов металлов с кислотами важным фактором в химических процессах и применении данных соединений в различных отраслях науки и промышленности.
Учение о процессах образования

Взаимодействие карбоната металла с кислотой является одним из основных процессов в химии и образовании. Этот процесс, известный также как реакция нейтрализации, заключается в том, что ионы карбоната металла соединяются с ионами водорода из кислоты, образуя соль, воду и углекислый газ.
В образовательном процессе изучается и понимается, как происходит образование солей, воды и углекислого газа при реакции карбоната металла с различными кислотами. Ученики изучают основные принципы реакций нейтрализации и узнают, какие факторы могут влиять на скорость и итоговые продукты реакций.
Учебный процесс по образованию включает в себя как теоретическую, так и практическую части. Учащиеся изучают реакции карбоната металла с различными кислотами на уровне молекулярной и ионной структуры. Они также проводят лабораторные эксперименты, чтобы наблюдать и измерять скорость реакций и анализировать полученные продукты.
Изучение процессов образования при взаимодействии карбоната металла с кислотой важно для понимания химических реакций, образования и применения солей, а также для развития навыков лабораторной работы и исследовательского мышления учащихся. Эта тема помогает ученикам углубить свои знания в области химии и расширить свое понимание мира вокруг себя.
Роль карбоната металла в химических реакциях

Карбонат металла является важным участником химических реакций, особенно взаимодействия с кислотами. Когда карбонат металла вступает в контакт с кислотой, происходит так называемая нейтрализационная реакция, в результате которой образуются соль, вода и углекислый газ.
Карбонат металла, например, карбонат кальция (CaCO3), может реагировать с различными кислотами, например, соляной кислотой (HCl). В ходе реакции карбонат кальция и соляная кислота образуют соль - хлорид кальция (CaCl2), воду (H2O) и углекислый газ (CO2) в виде пузырьков.
Реакция между карбонатом металла и кислотой является основной причиной образования осадков в природных водах и почвах. Когда дождевая вода протекает через почву или стекает по каменной поверхности, она может растворять карбонаты металла и дотекать до подземных источников воды. При дальнейшем взаимодействии с кислотами, присутствующими в почве или воде, происходит осаждение карбонатов металла в виде тонких слоев или кристаллов.
Таким образом, карбонаты металла играют важную роль в химических превращениях, участвуя в нейтрализации кислот и создании новых соединений, а также в процессах формирования осадочных пород и влиянии на состав природных вод и почв.
Важность кислоты во взаимодействии
Взаимодействие карбоната металла с кислотой является важным процессом в образовании природных и искусственных материалов. Кислота играет роль активатора реакции, обеспечивая корректное протекание процесса.
Кислота позволяет вступить в химическую реакцию с карбонатом металла, образуя новые соединения. Это взаимодействие основано на принципе обмена ионами, при котором ионы металла выделяются в раствор, а вместо них в кристаллическую решетку встраиваются ионы водорода или других металлов. Этот процесс приводит к изменению строения и свойств материала.
Для успешного взаимодействия кислоты с карбонатом металла важно правильно выбрать кислоту. Свойства кислоты, такие как силы ионов и концентрация, могут влиять на скорость и интенсивность реакции. Некоторые кислоты могут образовывать стабильные соединения с карбонатами металлов, что снижает эффективность процесса образования новых материалов.
Оптимальное взаимодействие карбоната металла с кислотой позволяет получать материалы с новыми свойствами и характеристиками, что имеет большое значение в различных областях, включая промышленность, строительство, медицину и т.д. Таким образом, понимание важности кислоты во взаимодействии с карбонатом металла помогает развить новые материалы и технологии, способствующие прогрессу и инновациям.
Механизмы возникновения реакций при взаимодействии карбоната металла с кислотой

1. Протонный механизм. При взаимодействии карбоната металла с кислотой, протоны из кислоты передаются на карбонатные и гидроксильные группы металла. Это приводит к образованию солей и выделению углекислого газа. Например, при реакции карбоната кальция с соляной кислотой, образуется хлорид кальция и выделяется углекислый газ.
2. Диспроциюзионный механизм. Данный механизм возникает при растворении карбоната металла в кислой среде. Кислота диссоциирует на ионы водорода и анионы, которые образуют соль с металлом. Данный механизм особенно характерен для карбонатов металлов с низкой растворимостью и хорошей кристаллической структурой.
3. Реакция коагуляции. При взаимодействии карбоната металла с кислотой, происходит образование Льюисовой пары, которая приводит к образованию соли и выделению углекислого газа. Например, при реакции карбоната магния с уксусной кислотой, образуется ацетат магния и выделяется углекислый газ.
4. Реакция нуклеофильной замены. При этом механизме карбонат металла вступает в реакцию с кислотой, образуя кислотные соли и выделяя углекислый газ. Например, при взаимодействии карбоната натрия с соляной кислотой, образуется хлорид натрия и выделяется углекислый газ.
Диссоциация карбоната металла в растворе

Карбонат металла представляет собой соединение, состоящее из карбонатного и катионного компонентов. В растворе карбонаты металла разлагаются на ионы карбоната (CO3^2-) и ионы металла. Диссоциация карбоната металла в растворе протекает по следующему механизму:
- Шаг 1: Карбонатное соединение погружается в воду или раствор кислоты.
- Шаг 2: В результате взаимодействия с водой или кислотой происходит разложение карбоната на ионы карбоната и ионы металла.
- Шаг 3: Ионы металла и ионы карбоната растворяются в растворе, образуя гидратированные ионы металла и гидратированные ионы карбоната.
Реакция диссоциации карбоната металла является обратимой и может протекать в обе стороны. При снижении концентрации ионов металла или ионов карбоната, обратная реакция может преобладать и карбонат металла осаждается в виде твердого вещества.
Диссоциация карбоната металла в растворе имеет важное значение в химии и технологии. Это явление позволяет использовать карбонаты металла для получения соединений металла или для образования отложений в обрабатываемых материалах. Также, знание диссоциации карбоната металла позволяет точнее предсказывать свойства и поведение соединений, содержащих карбонаты металла.
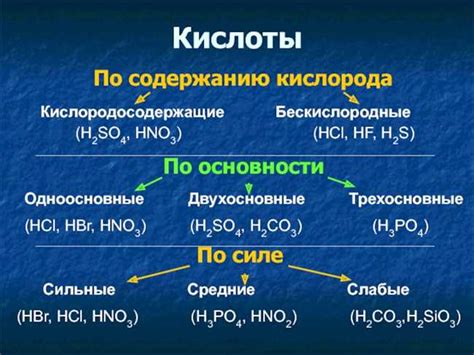
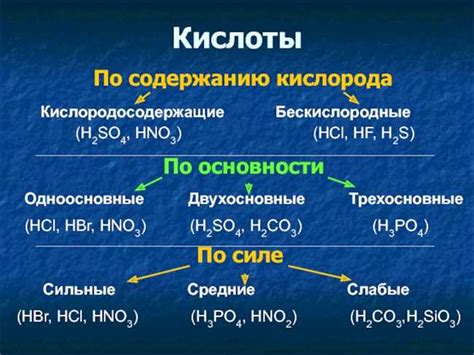
Свойства и особенности кислоты
Кислота - это химическое вещество, которое образует ион водорода (H+) при растворении в воде. Кислоты могут быть органическими (содержащими углерод) или неорганическими (не содержащими углерод).
Основные свойства кислот:
- Кислотные свойства. Кислоты реагируют с основаниями, образуя соль и воду. Это называется нейтрализацией. Кислоты также реагируют с металлами, образуя соль и выделяя водород.
- Кислотность. Кислоты могут быть крепкими (полностью ионизируются в воде) или слабыми (частично ионизируются в воде).
- pH. Кислоты имеют низкий уровень pH (менее 7). Чем ниже pH, тем сильнее кислота.
- Электролитические свойства. Кислоты являются электролитами, так как разлагаются на ионы в водном растворе и могут проводить электрический ток.
- Свойства окрашивания. Некоторые кислоты имеют окрашивающие свойства и могут изменять цветы некоторых веществ.
Кислоты широко используются в разных областях, включая химическую промышленность, медицину, пищевую промышленность и домашний хозяйстве. Они играют важную роль в образовании и непосредственно взаимодействуют с различными веществами, такими как металлы, для создания различных реакций и продуктов.
Результаты экспериментов

В ходе проведения экспериментов было выявлено, что взаимодействие карбоната металла с кислотой приводит к образованию газа. Карбонат металла распадается на металл и углекислый газ. Данная реакция происходит в присутствии кислоты, которая служит активатором процесса.
Одним из заметных результатов экспериментов является образование пузырьков газа при контакте карбоната металла с кислотой. Пузырьки газа поднимаются вверх и высвобождаются, что является признаком химической реакции. Более того, наблюдается эффервесценция - химическая реакция, сопровождающаяся выделением газа в виде пузырьков.
В результате экспериментов была также установлена зависимость скорости образования газа от концентрации кислоты. Чем выше концентрация кислоты, тем быстрее и интенсивнее образуется газ. Этот факт объясняется тем, что более концентрированная кислота обладает большей активностью и способностью взаимодействовать с карбонатом металла.
Таким образом, результаты экспериментов подтверждают, что взаимодействие карбоната металла с кислотой приводит к образованию газа. Эти результаты могут быть использованы в дальнейших исследованиях в области химии и образования, а также в практической деятельности, например, при разработке новых методов анализа и синтеза веществ.
Примеры образования соединений
При взаимодействии карбоната металла с кислотой образуются различные соединения, которые могут иметь различные свойства и применения.
Например, при взаимодействии карбоната натрия (Na2CO3) с соляной кислотой (HCl) образуется хлорид натрия (NaCl) и углекислый газ (CO2). Хлорид натрия является растворимым солью, которая находит широкое применение в пищевой промышленности и других отраслях.
Карбонат кальция (CaCO3), в свою очередь, взаимодействуя с уксусной кислотой (CH3COOH), образует ацетат кальция (Ca(CH3COO)2) и углекислый газ. Ацетат кальция применяется в медицине, пищевой промышленности и других отраслях как пищевая добавка, регулятор кислотности и прочее.
Также можно привести пример взаимодействия карбоната меди (CuCO3) с азотной кислотой (HNO3), в результате которого образуется нитрат меди (Cu(NO3)2) и углекислый газ. Нитрат меди находит применение в химической промышленности для получения других соединений меди и в других областях.
Влияние факторов на скорость реакции

Температура. Одним из основных факторов, влияющих на скорость реакции между карбонатом металла и кислотой, является температура окружающей среды. При повышении температуры частицы веществ начинают двигаться быстрее, что способствует частым столкновениям и, соответственно, увеличению скорости реакции. Таким образом, при повышении температуры происходит ускорение реакции между карбонатом металла и кислотой.
Концентрация реагентов. Влияние концентрации реагентов на скорость реакции также необходимо учитывать. При увеличении концентрации реагентов количество частиц в единице объёма увеличивается, что приводит к увеличению вероятности их столкновений и, следовательно, ускорению реакции. Следует отметить, что данное влияние наблюдается только в тех случаях, когда концентрация реагентов является определяющим фактором для скорости реакции.
Поверхность реагентов. Поверхность реагентов также оказывает влияние на скорость реакции между карбонатом металла и кислотой. При наличии большой поверхности вещества, доступной для взаимодействия с другими реагентами, скорость реакции повышается. Это объясняется тем, что большая поверхность обеспечивает большую площадь столкновения между частицами реагентов, что в свою очередь ускоряет реакцию. Таким образом, можно сделать вывод о том, что повышение поверхности реагентов приводит к увеличению скорости реакции.
Использование катализаторов. Катализаторы могут оказывать значительное влияние на скорость реакции между карбонатом металла и кислотой. Катализаторы увеличивают скорость реакции путем уменьшения энергии активации, необходимой для инициирования реакции. Они участвуют в реакции, но не изменяются в ходе ее прохождения. Таким образом, использование катализаторов позволяет ускорить реакцию и повысить ее эффективность.
Влияние растворителя. Растворитель может оказывать влияние на скорость реакции между карбонатом металла и кислотой. Растворитель может увеличивать или уменьшать скорость реакции в зависимости от своей природы и взаимодействия с реагентами. Например, в случае реагирования карбоната металла с кислотой в водном растворе, вода может увеличивать скорость реакции, так как обеспечивает оптимальные условия для переходных состояний и взаимодействия между реагентами. Однако, другие растворители могут оказывать противоположное воздействие на скорость реакции. Поэтому, выбор растворителя может быть важным фактором для контроля скорости реакции.
Вопрос-ответ

Что такое карбонат металла?
Карбонат металла - это химическое соединение, содержащее карбонатную группу (CO3) и металлический ион. Он часто используется в промышленности и научных исследованиях.
Как происходит взаимодействие карбоната металла с кислотой?
При взаимодействии карбоната металла с кислотой происходит химическая реакция, в результате которой образуется соль металла и углекислый газ (CO2). Карбонатная группа распадается, а металлический ион соединяется с ионами кислоты, образуя соль.
