Щелочноземельные металлы являются важной группой элементов в периодической системе химических элементов. Они включают в себя бериллий, магний, кальций, стронций, барий и радий. Эти металлы отличаются своими уникальными химическими свойствами и широким спектром возможных соединений.
Соли щелочноземельных металлов представляют собой соединения, в которых щелочноземельные металлы выступают в качестве катионов. Они обладают различными свойствами и имеют широкое применение в различных отраслях науки и промышленности.
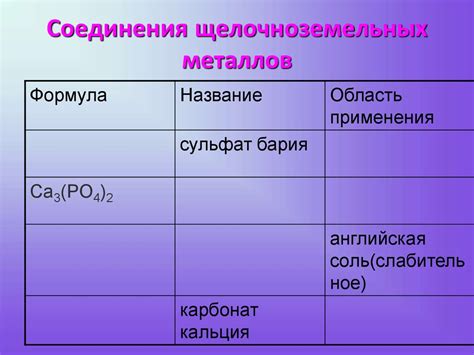
Примерами солей щелочноземельных металлов являются бериллий хлорид (BeCl2), магний сульфат (MgSO4), кальций карбонат (CaCO3), стронций нитрат (Sr(NO3)2), барий хлорид (BaCl2) и радий бромид (RaBr2).
Соли этой группы металлов обладают различными физическими и химическими свойствами. К примеру, они являются кристаллическими соединениями, образующими кристаллы различной формы. Они также обладают высокой тройкой и плавятся при достаточно высоких температурах. Кроме того, они растворимы в воде и способны образовывать гидраты.
Соли щелочноземельных металлов
Щелочноземельные металлы - это элементы группы 2 периодической системы Д.И. Менделеева. Они включают в себя бериллий, магний, кальций, стронций, барий и радий. Эти металлы обладают сходными свойствами, включая высокую температуру плавления, низкую плотность и хорошую термическую и электрическую проводимость.
Соли щелочноземельных металлов являются соединениями, в которых металлическое катионное ядро образует ионную связь с анионом. Примерами таких солей могут служить хлориды, сульфаты, нитраты и другие.
Одной из особенностей солей щелочноземельных металлов является их высокая растворимость. Бериллий и его соединения являются исключением из этого правила, так как они обладают низкой растворимостью. Кроме того, соли щелочноземельных металлов обладают светочувствительностью и используются в фотографии, а также в производстве стекла и керамики.
Соли щелочноземельных металлов также имеют широкий спектр применения в промышленности и научных исследованиях. Например, магнийсульфат используется в медицине как слабительное, а кальцийхлорид применяется для удаления льда с дорог и тротуаров. Барийсульфат используется в радиологии для проведения рентгеновских исследований.
Примеры

Соли щелочноземельных металлов представляют собой соединения, содержащие ионы щелочноземельных металлов, таких как магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Одним из наиболее распространенных примеров соли щелочноземельных металлов является карбонат кальция (CaCO3), который широко используется в строительстве и производстве цемента.
Еще одним примером является сульфат магния (MgSO4), который применяется в медицине как слабительное и в сельском хозяйстве как удобрение.
Важным примером является также хлорид бария (BaCl2), который используется в процессе производства стекла и как добавка для улучшения светопропускания.
Следует отметить, что соли щелочноземельных металлов имеют различные свойства и широко применяются в разных сферах деятельности, начиная от медицины и сельского хозяйства, заканчивая строительством и производством стекла.
Свойства
1. Щелочноземельные металлы – это элементы группы 2 периодической системы. Они включают бериллий, магний, кальций, стронций, барий и радий. Все эти элементы обладают схожими свойствами, так как имеют два валентных электрона на внешнем энергетическом уровне.
2. Они реактивны и легко образуют соединения с другими элементами. Щелочноземельные металлы реагируют со многими кислотами, нерастворимыми основаниями, аммиаком и водными пара-щелочами.
3. Щелочноземельные металлы имеют низкую плотность и низкую температуру плавления по сравнению с другими металлами. Например, литий – самый легкий металл, который обладает самой низкой плотностью из всех металлов.
4. Они образуют ионы с положительной зарядой, обычно равной +2. Когда металл образует ион, он теряет два валентных электрона. Это обусловлено тем, что электроны стараются достичь нейтральных нижних энергетических уровней, и для этого им необходимо отдать эти два электрона.
5. Щелочноземельные металлы являются хорошими проводниками тепла и электричества. Они обладают высокой электропроводностью благодаря свободно движущимся электронам в кристаллической решетке металлов.
Вопрос-ответ

Какие знаки определяют соли щелочноземельных металлов?
Соли щелочноземельных металлов можно определить по общей формуле MX₂, где M - металл щелочноземельного ряда (кальций, магний, стронций, барий, радий), а X - любой отрицательный радикал (анализрующий гидроксид, борат, карбонат, фторид и др.).
Какие свойства обладают соли щелочноземельных металлов?
Соли щелочноземельных металлов обладают следующими свойствами: кристаллическая решетка, высокая температура плавления и испарения, соляной вкус, хорошая растворимость в воде, возможность образования гидратов, прекрасное химическое стабильность, стойкость к окислению и редукции.
На что влияет радиус и заряд ионов щелочноземельных металлов?
Радиус и заряд ионов щелочноземельных металлов играют решающую роль в формировании их свойств. Большие положительные заряды ионов и их маленький радиус позволяют им образовывать сильные электростатические связи и увеличить температуру плавления солей. Более того, радиус и заряд ионов могут также определять их растворимость, стехиометрию и реакционную способность.
Какие соли щелочноземельных металлов являются наиболее распространенными?
Наиболее распространенными солями щелочноземельных металлов являются сульфаты, хлориды, нитраты, ацетаты, фосфаты и гидроксиды. Эти соли используются в различных отраслях промышленности: от производства удобрений до промышленного производства лекарственных препаратов.
Какие примеры можно привести солей щелочноземельных металлов?
Примерами солей щелочноземельных металлов могут быть карбонат кальция (CaCO₃), сульфат магния (MgSO₄), хлорид стронция (SrCl₂), нитрат бария (Ba(NO₃)₂) и гидроксид радия (Ra(OH)₂).
