Реакции щелочных металлов с фтором и растворами солей являются важными объектами изучения в химии. Их аналогия позволяет проводить сопоставительный анализ и выявлять закономерности в химических реакциях этих веществ. Щелочные металлы, такие как натрий, калий и литий, проявляют схожее поведение при взаимодействии с фтором и солями других металлов.
Фтор является самым электроотрицательным элементом, поэтому его реакция с щелочными металлами характеризуется высокой степенью энергетической активности. При этом образуются хлориды, бромиды или иодиды металлов, а галоген исчезает. Реакция проходит с выделением большого количества тепла и света.
Взаимодействие щелочных металлов с растворами солей других металлов приводит к образованию осадка, состоящего из соответствующих солей. Наиболее характерными осадками являются карбонаты, гидроксиды и сульфаты. Эти реакции нередко используются в лабораторных условиях для определения наличия или содержания определенного металла в растворе.
Исследование аналогии реакций щелочных металлов с фтором и растворами солей является важным шагом в понимании основных принципов химии и установлении связей между различными химическими процессами. Такое изучение позволяет строить прогнозы о химическом поведении веществ и применять эти знания для развития различных отраслей науки и техники.
Щелочные металлы и их реакции

Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой активностью и легко реагируют с различными веществами.
Одной из наиболее характерных реакций щелочных металлов является их взаимодействие с фтором. При этом образуется соль фторида соответствующего щелочного металла. Так, например, реакция натрия с фтором приводит к образованию натрия фторида:
2Na + F2 → 2NaF
В результате такой реакции образуются белые кристаллы натрия фторида, которые хорошо растворяются в воде.
Щелочные металлы также реагируют с растворами солей других металлов. Например, они могут вытеснять из растворов ион металла и занимать его место. Это явление называется вытеснением металла из своей соли. Например, литий может вытеснить натрий из его солей:
2Li + 2NaCl → 2LiCl + Na2
Таким образом, щелочные металлы демонстрируют высокую активность и способны образовывать разнообразные соединения с другими элементами.
Щелочные металлы и фтор
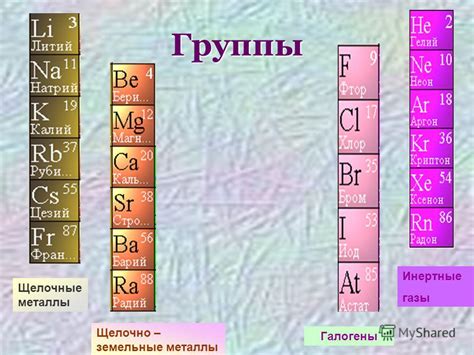
Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой реакционной способностью и легкостью образования ионов со знаком +1.
Фтор – это химический элемент, который относится к галогенам и находится во второй группе периодической таблицы. Фтор является самым электроотрицательным элементом, поэтому его соединения обладают высокой реакционной способностью и часто применяются в промышленности и медицине.
Взаимодействие щелочных металлов с фтором приводит к образованию ионов металла с знаком +1 и ионов фторида с знаком -1. Эта реакция происходит с выделением значительного количества тепла и сопровождается ярким свечением и пламенем.
Процесс реакции щелочных металлов и фтора можно представить в виде следующей химической формулы:
2M + F2 → 2MF
Где M обозначает щелочный металл, а F2 обозначает молекулярный фтор.
Реакция щелочных металлов с фтором является очень быстрой и интенсивной, поэтому необходимо соблюдать осторожность при ее проведении, так как она может привести к возгоранию или взрыву.
Реакции щелочных металлов с фтором
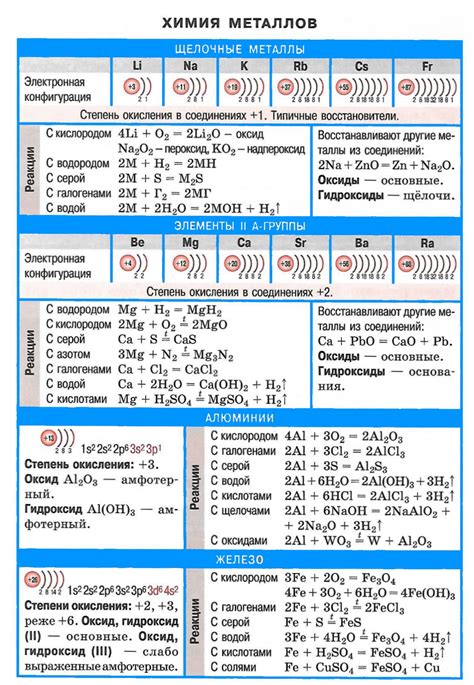
Фтор – это самый активный химический элемент из группы галогенов. Он имеет очень высокое электроотрицание и образует сильные соединения с многими другими элементами. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, реагируют с фтором, приводя к образованию различных соединений.
Взаимодействие щелочных металлов с фтором происходит с выделением большого количества энергии в виде тепла и света. Эта реакция является экзотермической и обычно происходит очень интенсивно. При взаимодействии лития с фтором образуется соединение лихтат лития (LiF).
Взаимодействие натрия с фтором приводит к образованию таких соединений, как фторид натрия (NaF) и галогенид натрия (NaX, где X - галоген). Эти соединения имеют высокую степень ионности и обладают химической стабильностью. Они широко используются в различных отраслях промышленности.
Реакции щелочных металлов с фтором могут проходить в разных условиях. Например, реакции можно проводить в атмосфере или в тигле с использованием специальных реакционных условий. Важно отметить, что при обработке реагентов следует соблюдать меры безопасности, так как фтор является высокотоксичным веществом и может вызывать серьезные ожоги и отравления.
В целом, реакции щелочных металлов с фтором проявляются в высокой энергетичности и выделении яркого света. Они используются в различных технологических процессах, а также имеют важное значение в научных исследованиях.
Реакции щелочных металлов с растворами солей
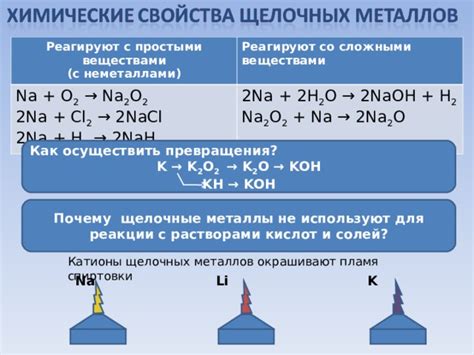
Щелочные металлы, такие как натрий, калий и литий, обладают высокой реакционной способностью и проявляют себя как очень активные элементы. Одним из их интересных свойств является их взаимодействие с растворами солей, которое может привести к образованию новых веществ и проявлению химических реакций.
При обработке растворов солей щелочными металлами происходит образование осадков или изменение цвета растворов. Эти реакции часто используются в химическом анализе для идентификации и разделения ионов в растворах.
Натрий, калий и литий являются сильными восстановителями, поэтому могут взаимодействовать с ионами металлов в растворах солей и превращать их в соответствующие металлы или осадки. Например, если в растворе содержатся ионы меди, реакция с натрием или калием может привести к образованию осадка красного цвета - оксида меди (I):
- 2Cu^+ + 2Na → 2Na^+ + 2Cu +
- 2Cu^+ + 2K → 2K^+ + 2Cu +
Натрий и калий также могут взаимодействовать с ионами серебра в растворах солей и образовывать осадок белого цвета - оксида серебра (I):
- 2Ag^+ + 2Na → 2Na^+ + 2Ag +
- 2Ag^+ + 2K → 2K^+ + 2Ag +
Эти реакции могут быть использованы для разделения ионов серебра от других металлов в аналитических исследованиях.
Химические свойства щелочных металлов
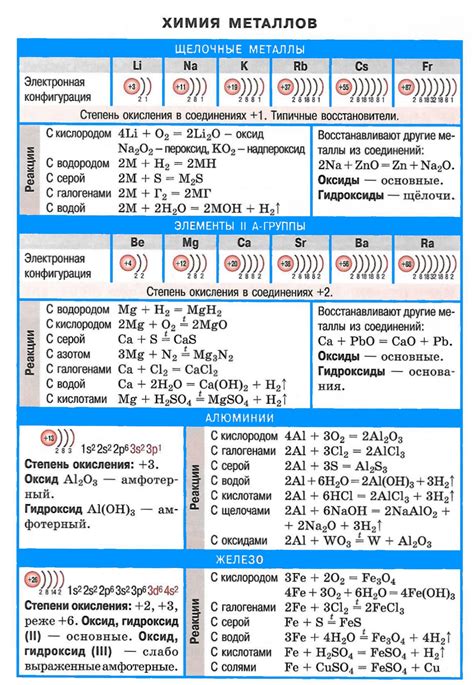
Щелочные металлы - это элементы первой группы периодической системы, а именно литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом уникальных химических свойств, которые делают их важными и широко используемыми элементами.
Одной из основных характеристик щелочных металлов является активность. Они являются металлами-щелочами, то есть они оказывают щелочное действие, реагируя с водой или кислотами. При контакте с водой они образуют гидроксиды, выделяя водород. Кроме того, они легко реагируют с кислородом и другими неметаллами, образуя оксиды или соли с кислотами.
Щелочные металлы также характеризуются низкой плотностью и низкой температурой плавления. Благодаря этим свойствам, они широко используются в производстве легких сплавов, а также в пиротехнике, где они обеспечивают яркие пламенные эффекты.
Кроме того, щелочные металлы обладают высокой электроотрицательностью и образуют ионы положительного заряда. Именно благодаря этому свойству они легко образуют соли и стабильные соединения с различными отрицательными ионами. В реакциях с фтором и растворами солей они показывают высокую реакционную способность и образуют стабильные фториды и ионные соединения.
Таким образом, химические свойства щелочных металлов делают их важными элементами в различных областях, начиная от промышленности до медицины и научных исследований. Их активность, низкая плотность, низкая температура плавления и способность образовывать стабильные соединения делают их неотъемлемой частью современного химического мира.
Важность реакций щелочных металлов для промышленности

Реакции щелочных металлов с фтором и растворами солей имеют огромную важность для промышленности, так как обеспечивают производство широкого спектра продуктов и материалов, которые необходимы в различных отраслях экономики.
Щелочные металлы, такие как натрий, калий и литий, являются основными компонентами многих промышленных процессов. Они используются в производстве щелочей, солей, сплавов, стекла, керамики и многих других материалов.
Реакция щелочных металлов с фтором позволяет получать фториды, которые широко применяются в химической промышленности, металлургии, электронике и других отраслях. Фториды, например, используются в производстве алюминия и свинца, в качестве реагентов при получении других химических соединений и материалов.
Реакции щелочных металлов с растворами солей также являются важной составляющей многих технологических процессов. Например, растворимые соли щелочных металлов используются в гальваническом производстве, в процессах электрохимической обработки поверхности металлов, в качестве электролитов для аккумуляторов и батарей, а также в других процессах, где требуется определенная химическая активность и реакционная способность.
В итоге, реакции щелочных металлов с фтором и растворами солей играют важную роль в промышленности, обеспечивая производство разнообразных продуктов и материалов, которые являются неотъемлемой частью нашей повседневной жизни. Они позволяют создавать новые технологии, улучшать качество продукции и способствуют развитию различных отраслей экономики.
Вопрос-ответ

Какие реакции происходят между щелочными металлами и фтором?
Реакции щелочных металлов с фтором приводят к образованию щелочных фторидов. Например, реакция натрия с фтором приводит к образованию натриевого фторида (NaF).
Какие реакции происходят между щелочными металлами и растворами солей?
Реакции щелочных металлов с растворами солей могут привести к образованию осадка, растворению соли или наблюдению изменения цвета раствора. Реакции могут зависеть от конкретных солей и металлов, участвующих в реакции.
Для чего используют аналогию реакций щелочных металлов с фтором и растворами солей?
Аналогия реакций щелочных металлов с фтором и растворами солей может помочь в понимании общих принципов реакций и химических свойств щелочных металлов. Она позволяет увидеть схожие механизмы и результаты реакций с различными соединениями.
Какие особенности имеют реакции щелочных металлов с фтором и растворами солей?
Реакции щелочных металлов с фтором обычно протекают быстро и с выделением тепла. Реакции с растворами солей зависят от конкретных солей и металлов, но часто проявляется образование осадка, растворение соли или изменение цвета раствора.
