Радиус атома - это физическая характеристика, которая показывает расстояние от центра атома до его внешних электронов. Она имеет важное значение в химии и физике, поскольку влияет на свойства вещества. В этой статье мы рассмотрим сравнение радиусов атомов металлов и неметаллов и выясним, кто из них обладает большими или меньшими атомами.
Металлы и неметаллы - основные классы элементов в периодической системе. Они имеют разные химические и физические свойства, включая размеры атомов. Обычно атомы металлов имеют больший радиус, чем атомы неметаллов. Это объясняется особенностями строения атома и его электронной оболочки.
Атомы металлов имеют меньшую электроотталкивающую силу между электронами, что позволяет им быть более компактными. Вместе с тем, атомы неметаллов имеют более высокую электроотталкивающую силу, что делает их атомы более разорванными и, соответственно, более объемными.
Несмотря на это общее правило, есть исключения. Некоторые неметаллы, такие как кислород и фтор, имеют малый радиус атомов, поскольку они образуют двойные и тройные связи, что делает их атомы компактнее и меньше. С другой стороны, некоторые металлы, такие как галлий и иттрий, могут иметь большие радиусы атомов из-за особых структурных особенностей их кристаллической решетки.
Сравнение радиусов атомов металлов и неметаллов
Атомы металлов и неметаллов обладают разными размерами, которые определяются их химическими свойствами и электронной структурой. Обычно атомы металлов имеют больший радиус, чем атомы неметаллов.
Разница в радиусе атомов металлов и неметаллов связана с их расположением в периодической системе элементов. Металлы находятся слева от периодической системы, а неметаллы - справа. Это связано с тем, что атомы металлов имеют меньшее количество электронов в последних энергетических оболочках, чем атомы неметаллов.
Маленький радиус атомов неметаллов обусловлен большим числом электронов заряда ядра. У неметаллов также преобладает электронная негативность, что объясняет их способность принимать электроны и образовывать отрицательные ионы.
С другой стороны, у металлов больше электронов в внешней энергетической оболочке. В результате атомы металлов имеют больший радиус, так как электроны между ядром и внешней оболочкой создают слабое отталкивание и не притягиваются сильно к ядру.
Таким образом, атомы металлов обычно имеют больший радиус, чем атомы неметаллов. Это связано с различной электронной структурой и электронными взаимодействиями внутри атомов разных элементов.
Более крупные радиусы у металлов
Металлы характеризуются большими радиусами атомов по сравнению с неметаллами. Это связано с особенностями строения атомов металлов. Одной из основных характеристик металлов является наличие свободных электронов во внешней оболочке атома.
Эти свободные электроны формируют так называемый "электронный газ", который способствует плотной упаковке атомов металла друг к другу. В результате этого атомы металлов обладают большим размером и межатомные расстояния оказываются больше, чем у неметаллов.
Большие радиусы атомов металлов имеют практическое значение. Например, они способствуют легкому движению электронов в проводимости металлов и обеспечивают их высокую электропроводность.
Малые радиусы у неметаллов
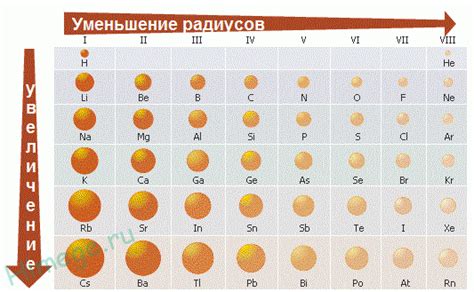
В отличие от металлов, неметаллы обладают намного меньшими радиусами атомов. Это связано с особенностями строения и химической природы неметаллических элементов.
Неметаллы образуют сильные ковалентные связи между атомами, которые прочно удерживают их вместе. Ковалентная связь возникает при совместном использовании электронов во внешней оболочке атомов, что ведет к образованию молекул. Это объясняет, почему неметаллы образуют газообразное или молекулярное состояние при комнатной температуре.
Ковалентные связи приводят к тому, что атомы неметаллов полностью заполняют свои внешние энергетические оболочки электронами, что делает их радиусы очень маленькими. Например, радиус атома кислорода составляет всего около 66 пикометров (пм), тогда как радиус атома железа составляет около 156 пикометров.
Малые радиусы неметаллов делают их активными элементами в химических реакциях. Они часто образуют больше связей с другими элементами и могут образовывать сложные молекулы с различными свойствами. Например, кислород может образовывать двойные и тройные связи с другими элементами, что позволяет ему образовывать многочисленные соединения и играть важную роль в процессах дыхания и окисления.
Различия в электронной конфигурации

Одно из главных различий между металлами и неметаллами заключается в их электронной конфигурации. Металлы, как правило, имеют малое количество электронов в своей внешней оболочке. Это делает их склонными отдавать электроны при взаимодействии с другими элементами.
Напротив, неметаллы имеют большое количество электронов в своей внешней оболочке. Это делает их склонными принимать электроны при взаимодействии с другими элементами. Неметаллы стремятся заполнить свою внешнюю оболочку, чтобы достичь стабильности.
Различия в электронной конфигурации металлов и неметаллов определяют их химические свойства. Металлы, отдавая электроны, образуют положительные ионы, и, в результате, обладают металлическими свойствами, такими как хорошая проводимость тепла и электричества.
Неметаллы, принимая электроны, образуют отрицательные ионы и обладают неметаллическими свойствами, такими как хорошая изоляция и низкая проводимость электричества.
Таким образом, различия в электронной конфигурации металлов и неметаллов играют ключевую роль в определении их химических свойств и поведения в химических реакциях.
Влияние электроотрицательности

Электроотрицательность - это способность атома притягивать к себе электроны в химической связи. Радиус атома, как правило, имеет обратную зависимость от его электроотрицательности. То есть, чем выше электроотрицательность атома, тем меньше его радиус.
Это связано с тем, что атомы с большой электроотрицательностью имеют сильное притяжение к электронам и, следовательно, их электронные облака сжимаются. В то же время, атомы с низкой электроотрицательностью имеют слабое притяжение к электронам и их электронные облака расширяются.
Примером металла с большим радиусом атома и низкой электроотрицательностью является калий (K). Его атом имеет большой размер, поскольку электроны отдаются другим атомам с легкостью, и при этом электронное облако размазано.
| Металлы | Атомный радиус (пикометры) | Электроотрицательность |
|---|---|---|
| Калий (K) | 231 | 0.82 |
| Магний (Mg) | 160 | 1.31 |
| Железо (Fe) | 156 | 1.83 |
С другой стороны, неметаллы, которые имеют высокую электроотрицательность, обычно имеют меньшие радиусы атомов. Это связано с тем, что они притягивают электроны к себе сильнее, и их электронные облака сжаты. Примером неметаллов с малым радиусом атома и высокой электроотрицательностью являются кислород (O) и фтор (F).
| Неметаллы | Атомный радиус (пикометры) | Электроотрицательность |
|---|---|---|
| Кислород (O) | 66 | 3.44 |
| Фтор (F) | 64 | 3.98 |
| Хлор (Cl) | 99 | 3.16 |
Таким образом, электроотрицательность влияет на радиус атома - чем выше электроотрицательность, тем меньше радиус атома. Это важный параметр, который определяет реакционную способность и химические свойства элементов.
Важность радиусов в химических реакциях
Радиусы атомов металлов и неметаллов играют важную роль в химических реакциях. Взаимодействие атомов и молекул зависит от их размеров и расположения в пространстве. Радиус атома определяет его объем и доступность для взаимодействия с другими частицами.
В химических реакциях атомы металлов и неметаллов могут обменивать электроны, образуя химические связи. Размер атома влияет на энергию образующейся связи и степень ее силы. Большие радиусы металлов способствуют образованию ионных связей, где электроны передаются от одного атома к другому. Это объясняет их высокую реакционную активность и способность образовывать соли.
В то же время, небольшие радиусы неметаллов обусловливают образование ковалентных связей, где электроны общие для двух атомов. Неметаллы имеют высокую электроотрицательность и образуют прочные ковалентные связи, приводя к образованию молекул. Это позволяет им обмениваться электронами в химических реакциях, образуя новые соединения.
Радиусы атомов также влияют на свойства веществ. Например, большие радиусы металлов обусловливают их мягкость и хорошую проводимость электричества. Небольшие радиусы неметаллов, напротив, ведут к твердым, хрупким веществам с низкой электрической проводимостью.
Таким образом, понимание и учет радиусов атомов металлов и неметаллов позволяет предсказывать и объяснять химические реакции и свойства веществ. Радиусы атомов являются важными параметрами, которые помогают понимать и описывать мир химии.
Зависимость между радиусом атома и его свойствами

Радиус атома - один из важных параметров, определяющих свойства вещества. Размер атома может оказывать значительное влияние на его химические и физические свойства.
Связь между радиусом атома и его свойствами объясняется электронной структурой. Атомы металлов имеют больший размер, чем атомы неметаллов. Это связано с тем, что металлы имеют меньшую электроотрицательность и более слабыю притяжение электронов к ядру. В результате этого, электроны в металлах могут свободно двигаться, образуя "электронное море". Это обусловливает особые свойства металлов, такие как высокая электропроводность и теплопроводность.
С другой стороны, атомы неметаллов имеют более маленький радиус и более сильное притяжение электронов к ядру. Это объясняет их высокую электроотрицательность и тенденцию к формированию ковалентных связей. Неметаллы часто образуют молекулы, в которых электроны разделяются между атомами, чтобы образовать связи.
Также радиус атома может влиять на объемную плотность вещества. С ростом размера атома увеличивается межатомное расстояние, что приводит к увеличению объема атомов, а следовательно, и к увеличению объема вещества. Это может сказываться на физических свойствах, таких как плотность и температура плавления.
Суммируя вышесказанное, можно сделать вывод, что радиус атома имеет прямое влияние на его химические и физические свойства. Большие атомы металлов обладают особыми свойствами, такими как электропроводность и теплопроводность, в то время как маленькие атомы неметаллов имеют высокую электроотрицательность и образуют ковалентные связи.
Применение радиусов атомов в материаловедении
Радиусы атомов металлов и неметаллов играют важную роль в материаловедении, так как они определяют множество свойств вещества. Размер атомов влияет на механические, термические, электронные и оптические характеристики материала.
Знание радиусов атомов позволяет прогнозировать структуру, связи и фазовые превращения материалов. Например, малые радиусы атомов металлов способствуют образованию плотной укладки и металлического свойства материала, таких как высокая теплопроводность и электропроводность.
С другой стороны, большие радиусы атомов неметаллов обусловливают образование кристаллов с открытой укладкой и ковалентной связью. Это приводит к образованию керамических и полупроводниковых материалов с уникальными электронными и диэлектрическими свойствами.
Радиусы атомов также определяют взаимодействие между атомами. Например, при формировании сплавов, радиусы атомов различных металлов определяют возможность растворения одного металла в другом. Различные комбинации радиусов могут создавать сильные или слабые связи между атомами, что влияет на прочность и эластичность материала.
Также, знание радиусов атомов позволяет контролировать процессы синтеза и модификации материалов. Изменение радиуса атомов может привести к изменению свойств материала, таких как магнитные, оптические или каталитические свойства.
В целом, радиусы атомов являются важным параметром при изучении и проектировании новых материалов, позволяя предсказывать и контролировать их свойства и поведение в различных условиях.
Выводы исследования сравнения радиусов

Основываясь на проведенном исследовании сравнения радиусов атомов металлов и неметаллов, можно сделать следующие выводы:
- Радиусы атомов металлов значительно больше, чем радиусы атомов неметаллов.
- Это объясняется тем, что атомы металлов имеют меньшую эффективность экранирования электронов своего ядра, что приводит к увеличению их размеров.
- Среди металлов самым большим радиусом обладает франций, который также является самым тяжелым элементом в таблице Mendeleev.
- Все неметаллы, в свою очередь, имеют небольшой радиус в сравнении с металлами.
- Атомы неметаллов хорошо экранируют свои электроны, что позволяет им иметь меньший размер.
- Самым маленьким радиусом среди неметаллов обладает гелий, самый легкий инертный газ.
Таким образом, сравнение радиусов атомов металлов и неметаллов подтверждает главное свойство металлов - их способность образовывать ионные связи с неметаллами, благодаря большим размерам и низкому электроотрицательности. Неметаллы же, с меньшими радиусами, образуют ковалентные связи между собой или с металлами.
Вопрос-ответ

Какие металлы имеют больший радиус?
Металлы обычно имеют больший радиус, чем неметаллы. Это связано с тем, что металлы имеют меньшее количество валентных электронов и слабее притягивают электроны к ядру. Это приводит к расширению радиуса атома металла.
Какой неметалл имеет больший радиус?
В целом, неметаллы имеют меньший радиус, чем металлы. Но можно сказать, что из неметаллов самые большие радиусы имеют элементы последней группы (группа азота, кислорода, фтора и др.). Это связано с тем, что элементы последней группы имеют большое количество валентных электронов и их электроны слабее притягиваются к ядру, что приводит к возрастанию радиуса атома.
