Металлы и неметаллы – основные элементы, из которых состоит наша окружающая среда. Они играют важную роль в химических реакциях и различных процессах, происходящих в живой и неживой природе. Взаимодействие металлов с неметаллами приводит к образованию различных соединений и проявляется в виде разнообразных химических реакций.
Одной из основных причин таких реакций является наличие жесткой связи между атомами металла и атомами неметалла, что обусловливает их ионные связи. В результате этого образуются соединения, которые могут иметь различные физические и химические свойства.
Примерами реакций металлов с неметаллами могут служить окислительно-восстановительные реакции, где металл выступает в роли окислителя, а неметалл – в роли восстановителя. Например, реакция кислорода с железом приводит к образованию окиси железа, при этом кислород восстанавливается, а железо окисляется.
Основные принципы реакций металлов с неметаллами
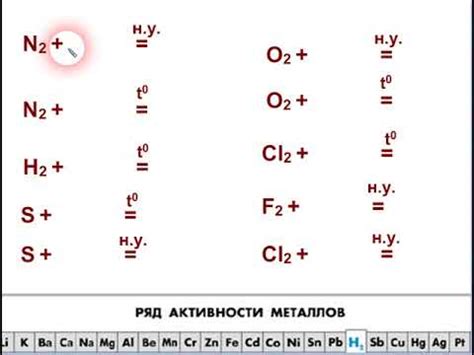
1. Ионная реакция. В основе реакций металлов с неметаллами лежит обмен ионами между металлом и неметаллом. Металл отдает электроны, образуя положительно заряженный ион, а неметалл принимает электроны, образуя отрицательно заряженный ион.
2. Образование ионных соединений. После обмена ионами, металл и неметалл образуют ионные соединения, состоящие из положительно и отрицательно заряженных ионов. В ионной решечке ионов металлов и неметаллов заряды должны быть сбалансированы, чтобы общая зарядность соединения была нейтральной.
3. Правило октаетричности. При реакциях металлов с неметаллами металлы часто отдают или получают электроны в таком количестве, чтобы их электронная конфигурация стала аналогичной электронной конфигурации ближайшего инертного газа. Такие атомы металлов обычно отдают или получают 1, 2 или 3 электрона.
4. Активность металлов. Реакционная способность металлов с неметаллами зависит от разницы в их электроотрицательности. Чем меньше электроотрицательность металла, тем активнее он будет реагировать с неметаллами.
5. Примеры реакций металлов с неметаллами. Некоторые известные реакции включают образование солей, оксидов и гидридов. Например, реакция меди с серой приводит к образованию меди(II)сульфида (CuS), реакция железа с кислородом приводит к образованию оксида железа (Fe2O3) и реакция натрия с хлором приводит к образованию хлорида натрия (NaCl).
Взаимодействие металлов и неметаллов: обзор

Взаимодействие металлов с неметаллами является одним из фундаментальных процессов в химии. Основным принципом реакций металлов и неметаллов является передача электронов, что приводит к образованию химической связи между атомами. В результате таких реакций образуются соединения, которые могут иметь различные физические и химические свойства.
Примером реакции металлов с неметаллами является образование соляных соединений. Например, реакция натрия, металла, с хлором, неметаллом, приводит к образованию хлорида натрия. В этой реакции натрий отдает один электрон хлору, образуя ион натрия с положительным зарядом Na+ и ион хлора с отрицательным зарядом Cl-. Оба иона привлекаются друг к другу электростатической силой и образуют соль.
Взаимодействие металлов и неметаллов может иметь различные последствия. Некоторые реакции могут быть сильно экзотермическими и сопровождаться выделением тепла и света, как, например, в случае реакции магния с кислородом, при которой образуется ярко горящий магниевый порошок. Другие реакции могут быть менее заметными, но все равно играют важную роль в химии и жизни в целом.
Механизмы реакций металлов с неметаллами
Реакции металлов с неметаллами основаны на принципах электронного переноса и образования ионов. Механизмы этих реакций могут быть различными в зависимости от типа неметалла и условий проведения эксперимента.
Одним из наиболее распространенных механизмов реакций металлов с неметаллами является образование ионов. В этом случае, металл отдает электроны неметаллу, образуя положительный ион металла и отрицательный ион неметалла. Примером такой реакции может служить образование хлорида натрия (NaCl), где натрий отдает электроны хлору, образуя ионы Na+ и Cl-.
Другим механизмом реакций металлов с неметаллами является обмен протонами. В этом случае, металл отдает протон неметаллу, образуя положительный ион металла и протонированный неметалл. Примером такой реакции может служить реакция цинка (Zn) с серой (S), при которой образуется сульфид цинка (ZnS) и ион H+.
Также существуют случаи, когда реакции металлов с неметаллами осуществляются через образование связи между атомами металла и неметалла. В этом случае, атомы металла и неметалла образуют ковалентную связь, что приводит к образованию соединения с характеристиками как металла, так и неметалла. Примером такой реакции может служить образование броссита (FeS2) при взаимодействии железа (Fe) и серы (S), где атомы железа и серы образуют ковалентную связь.
Принципы электронного переноса при взаимодействии металлов и неметаллов
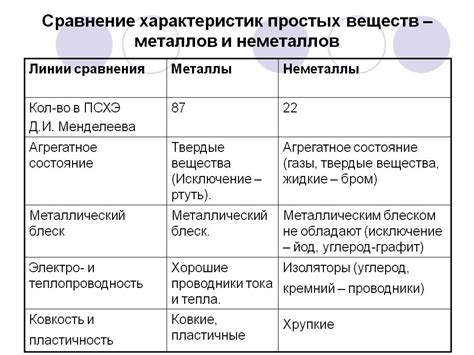
Взаимодействие металлов и неметаллов основано на принципе электронного переноса, который играет ключевую роль в химических реакциях. При контакте металлов с неметаллами происходит перенос электронов с одного атома на другой. Электроны в металлах находятся в проводимой зоне, что позволяет им легко передаваться от одного атома к другому.
В ходе реакции металла с неметаллом, неметалл обычно принимает электроны от металла и образует отрицательно заряженные ионы, а металл, в свою очередь, образует положительно заряженные ионы. Это приводит к образованию ионных соединений между металлом и неметаллом.
Примером такой реакции может служить взаимодействие натрия и хлора, в результате которого образуется хлорид натрия. При этом натрий, отдавая электрон, образует положительно заряженный ион, а хлор, принимая электрон, образует отрицательно заряженный ион. Эти ионы притягиваются друг к другу и образуют кристаллическую решетку хлорида натрия.
Стоит отметить, что при взаимодействии металлов и неметаллов также возможны другие виды реакций, например, реакция с обменом электронами или образование ковалентной связи. Однако основной принцип электронного переноса остается неизменным и является основой для понимания реакций между металлами и неметаллами.
Важные факторы, влияющие на реакцию металлов с неметаллами

Реакция металлов с неметаллами является важным процессом в химии и имеет множество применений в различных областях. Этот процесс может быть стимулирован и влияется на него ряд факторов, которые необходимо учитывать при изучении и предсказании химических реакций.
Один из ключевых факторов, влияющих на реакцию металлов с неметаллами, - активность элементов. Активность элемента характеризует его склонность к вступлению в химические реакции. Активные металлы, такие как натрий и калий, легко реагируют с неметаллами, такими как кислород и хлор. Они имеют большую тенденцию отдавать электроны и образовывать положительные ионы. Более активный металл в реакции может вытеснить менее активный металл из соединения. Например, цинк может вытеснить медь из ее соединений, таких как сульфат меди.
Другим важным фактором, влияющим на реакцию металлов с неметаллами, - электрохимический потенциал. Электрохимический потенциал связан с активностью элемента и представляет собой меру его склонности отдавать или принимать электроны. Эта характеристика можно использовать для предсказания потенциала реакций при взаимодействии определенных металлов с неметаллами. Металлы с более высоким электрохимическим потенциалом обычно реагируют с неметаллами с большей энергией.
Также важным фактором является концентрация реагентов и условия реакции. Высокая концентрация реагентов может способствовать более быстрой и интенсивной реакции. Температура, давление и наличие катализаторов также могут влиять на скорость и характер реакции. Некоторые реакции металлов с неметаллами могут происходить только при определенных условиях, таких как высокая температура или наличие специальных растворов.
Основываясь на этих факторах и знаниях о свойствах металлов и неметаллов, можно предсказать возможность и характ
Примеры реакций металлов с неметаллами: кислород и водород

Металлы, как активные элементы, могут реагировать с неметаллами, образуя соединения с новыми свойствами. Один из таких примеров - реакция металлов с кислородом.
Многие металлы способны сжигаться на воздухе, образуя оксиды. Например, железо при нагревании в присутствии кислорода образует оксид железа (III) Fe2+O3. Эта реакция сопровождается выделением тепла и света, именуется горением металла.
Другим интересным примером реакции металлов с неметаллами является реакция с водородом. Водород обладает сильными окислительными свойствами, поэтому может образовывать водородные соединения с металлами. Например, мы можем наблюдать реакцию металла цинка с кислотой соляной (HCl). В результате реакции образуется хлорид цинка (ZnCl2) и выделяется водородный газ.
Также, металлы способны реагировать с другими неметаллами, например, серой или галогенами. Сера может реагировать с металлическими порошками, образуя сульфиды. Например, реакцией меди и серы получается сульфид меди (II) Cu2+S.
Таким образом, реакции металлов с неметаллами являются важными процессами, они позволяют получать новые соединения с различными свойствами и применение.
Примеры реакций металлов с неметаллами: халкогены и галогены
Халкогены и галогены являются неметаллами, которые активно взаимодействуют с металлами. Реакции между металлами и халкогенами и галогенами характеризуются обменом электронами, в результате которого образуются соли.
Один из наиболее известных примеров реакций металлов с халкогенами – это образование халкогеновых галогенидов. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl). Эта реакция сопровождается выделением энергии и света.
Другой пример – реакция меди с серой. В результате обмена электронами образуется сульфид меди (CuS). Эта реакция также сопровождается выделением энергии и света.
Еще один пример реакции металла с неметаллом – реакция цинка с кислородом. В результате обмена электронами образуется оксид цинка (ZnO). Реакция цинка с водой также является примером реакции металла с неметаллом, в результате образуется гидроксид цинка (Zn(OH)2).
Таким образом, реакции металлов с халкогенами и галогенами являются распространенными и важными процессами, которые играют значительную роль во многих химических реакциях и процессах.
Вопрос-ответ

Какие реакции происходят при взаимодействии металлов с неметаллами?
Взаимодействие металлов с неметаллами приводит к образованию соединений, называемых солями. В зависимости от конкретных условий реакции, могут образовываться различные типы солей, такие как оксиды, гидроксиды, хлориды, сульфаты и т.д.
Какие основные принципы определяют реакции металлов с неметаллами?
Реакции металлов с неметаллами основаны на переносе электронов между металлом и неметаллом. Металл отдает электроны, становясь положительно заряженным ионом, неметалл принимает эти электроны, становясь отрицательно заряженным ионом. Таким образом, образуются ионы металла и неметалла, которые соединяются, образуя соль.
Можете привести примеры реакций металлов с неметаллами?
Да, конечно! Некоторые примеры реакций металлов с неметаллами включают взаимодействие натрия (Na) с хлором (Cl) при образовании хлорида натрия (NaCl), реакцию железа (Fe) с кислородом (O2) при образовании оксида железа (Fe2O3) и взаимодействие кальция (Ca) с серой (S) при образовании сульфида кальция (CaS).
Какие факторы могут влиять на скорость реакции металлов с неметаллами?
Скорость реакции металлов с неметаллами может зависеть от различных факторов, таких как температура, концентрация реагентов, поверхность контакта между реагентами и наличие катализаторов. В общем случае, более активные металлы имеют большую склонность к реакции с неметаллами и могут реагировать быстрее.
Каково значение реакций металлов с неметаллами в повседневной жизни?
Реакции металлов с неметаллами имеют огромное значение в повседневной жизни. Например, реакция железа с кислородом приводит к образованию ржавчины, которая является одной из основных проблем коррозии металлов. Также, реакции металлов с неметаллами используются в промышленности для получения различных продуктов, таких как соли, оксиды и другие соединения.
