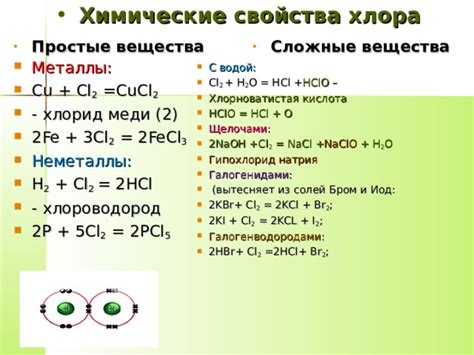
Хлор – это активный галоген, обладающий ярко выраженными окислительно-восстановительными свойствами. Он широко используется в промышленности, в частности, в химической промышленности, для получения различных соединений и веществ. Взаимодействие хлора с металлами является одним из способов использования окислительных свойств этого галогена.
Хлор проявляет высокую активность при взаимодействии с металлами, поскольку стремится заполучить один электрон и образовать ион с отрицательным зарядом – хлорид. Это связано с его высокой электроотрицательностью. В результате взаимодействия металлический элемент окисляется, а хлор восстанавливается.
Окислительно-восстановительные реакции с хлором используются для получения множества различных соединений металлов. Например, взаимодействие хлора с железом позволяет получить хлорид железа. Аллюминий при взаимодействии с хлором образует хлорид алюминия. Эти и другие окислительно-восстановительные реакции с хлором столь универсальны, что на их основе создаются различные хлориды металлов, которые имеют широкое применение в промышленности и научных исследованиях.
Хлор: свойства и взаимодействие

Хлор – химический элемент с атомным номером 17 и символом Cl. Он принадлежит к группе галогенов и является одним из наиболее активных элементов в периодической таблице. Хлор является газообразным при комнатной температуре и обладает ярко-зеленоватым цветом. Его запах считается характерным и проникающим, а его реактивность делает его полезным во многих химических процессах.
Окислительно-восстановительные свойства хлора делают его важным взаимодействующим агентом, особенно с металлами. Хлор может осуществлять окисление металлов, при этом сам восстанавливается. Во время взаимодействия с металлами, происходит образование металлических хлоридов.
Одной из характерных реакций хлора с металлами является образование хлоридов. Например, хлор реагирует с натрием, образуя хлорид натрия, а с алюминием образуется хлорид алюминия. Реакция хлора с металлами также может привести к образованию окислов, таких как оксид калия или оксид магния, при этом хлор сам окисляется до хлорида.
Окислительно-восстановительное взаимодействие хлора с металлами играет важную роль в промышленных процессах, таких как производство металлических хлоридов или получение чистых металлических образцов. Это свойство хлора также находит применение в области экологии, например, для очистки воды от загрязнений или дезинфекции питьевых систем.
Окислительные свойства хлора

Хлор – весьма активный оксидант, он обладает высокими окислительными свойствами. Взаимодействуя с металлами, хлор способен совершать окислительные реакции, выступая в роли достаточно сильного окислителя. Такие реакции часто сопровождаются образованием солей металлов с соответствующими хлоридами.
В химических реакциях хлор может выделять кислород, присоединяться к атомам водорода или электроны, что приводит к окислению других элементов. Например, при взаимодействии хлора с железом происходит окисление железа с образованием хлорида железа.
Хлор имеет способность окислять различные металлы разной степени активности. Например, хлор способен окислять цинк, свинец и многие другие металлы, образуя соответствующие хлориды. Окислительные свойства хлора могут быть полезными при различных технологических и промышленных процессах, а также в химическом анализе.
Окислительные свойства хлора также проявляются при его взаимодействии с органическими веществами. В этом случае хлор может окислять углеродные соединения, присоединяя к ним атом хлора и образуя органические хлориды. Органические хлориды обладают различными свойствами и могут применяться в разных областях, таких как фармацевтика, агрохимия и др.
Восстановительные свойства хлора
Хлор (Cl) – химический элемент, принадлежащий к галогенам. Он известен своими выраженными окислительными и восстановительными свойствами. В данном тексте рассмотрим особенности восстановительных свойств хлора при взаимодействии с металлами.
Восстановительные свойства хлора проявляются в его способности отдавать электроны при контакте с другими веществами. Самым распространенным примером взаимодействия хлора с металлами является их окисление водным раствором хлора в присутствии кислорода. При этом хлор сам проявляет восстановительные свойства, превращаясь в ионы хлорида (Cl-).
Восстановительные свойства хлора особенно сильны при взаимодействии с щелочными металлами, такими как натрий (Na) и калий (K). При их взаимодействии с хлором происходит интенсивная окислительно-восстановительная реакция, сопровождающаяся выделением тепла и образованием хлоридов соответствующих металлов.
Также восстановительные свойства хлора широко используются в промышленности и быту. Например, в химической промышленности хлор применяется для производства кислорода, хлорида натрия и других химических соединений. В быту он используется для обеззараживания питьевой воды, бассейнов и водоемов.
В заключение можно сказать, что восстановительные свойства хлора играют важную роль во многих процессах, связанных с окислительно-восстановительными реакциями. Они способствуют образованию соединений различной степени окисления и находят применение в различных отраслях науки и промышленности.
Хлор и его взаимодействие с металлами

Хлор – это элемент, относящийся к группе галогенов, обладающих выраженными окислительно-восстановительными свойствами. Когда хлор вступает в реакцию с металлами, происходит взаимодействие, в результате которого может проявляться его окислительная или восстановительная способность.
Хлор способен окислять металлы, отбирая у них электроны. При этом происходит образование ионов металла соответствующего заряда. Некоторые металлы, такие как железо или медь, способны реагировать с хлором уже при комнатной температуре, в то время как другие металлы требуют нагревания для запуска реакции.
С другой стороны, хлор может действовать как восстановительное средство в присутствии металлов, обладающих более высокой электрохимической активностью. В ходе реакции хлор отдает электроны, превращаясь в ионы хлора. При этом металл получает электроны и превращается в положительно заряженный ион.
Взаимодействие хлора с металлами может иметь различные последствия. Например, некоторые металлы могут быть растворены хлороводородной кислотой в результате их окисления хлором. Это можно наблюдать при реакции хлора с цинком или алюминием. С другой стороны, хлор может способствовать формированию пассивной стабильной пленки на поверхности некоторых металлов, таких как алюминий или нержавеющая сталь, что обеспечивает защиту от коррозии.
Хлор и железо: их взаимодействие

Хлор – химический элемент из группы галогенов, обладающий выраженными окислительными свойствами. Железо – металл, относящийся к семейству переходных элементов.
Когда хлор взаимодействует с железом, происходит окислительно-восстановительная реакция, в результате которой образуется хлорид железа. Одновременно хлор окисляет железо, переходя сам из ионов хлора к ионам хлорида.
Химическое уравнение реакции:
Fe + 2Cl₂ → 2FeCl₂
В данной реакции хлор выступает в качестве окислителя, так как он принимает электроны от железа, которое при этом окисляется. Сам хлор при этом сам восстанавливается, теряет электроны и превращается в ионы хлора.
Взаимодействие хлора с железом может протекать как в жидкой, так и в газообразной фазе. При этом реакция протекает более интенсивно при нагревании и в присутствии катализаторов, таких как железо или платина.
В результате взаимодействия хлора с железом образуется не только хлорид железа, но и некоторое количество хлорида гидрогена. Однако основной продукт – хлорид железа, используется в качестве промышленного и лабораторного реагента, а также в производстве железных сплавов и катализаторов.
Взаимодействие хлора с алюминием и медью

Хлор является очень активным химическим элементом, который обладает сильными окислительными свойствами. Он может реагировать с различными металлами, в том числе с алюминием и медью. Взаимодействие хлора с алюминием и медью происходит по-разному и имеет свои особенности.
Когда хлор взаимодействует с алюминием, происходит окисление алюминия. При этом хлор получает электроны от алюминия и превращается в ионы хлорида. Алюминий, в свою очередь, становится положительно заряженным ионом, который образует алюминиевый ион. В результате этой реакции образуется алюминиевый хлорид.
В отличие от алюминия, медь взаимодействует с хлором иначе. Хлор окисляет медь, отбирая у нее электроны, и становится ионом хлорида. Медь же превращается в положительно заряженный ион меди и образует ион меди(II) хлорида. Отмечается, что медь может образовывать с хлором не только одну, но и несколько степеней окисления, в зависимости от условий реакции.
Таким образом, взаимодействие хлора с алюминием и медью является примером окислительно-восстановительной реакции. Хлор выступает в роли окислителя, получая электроны от металлов и претерпевая самих в себе изменения. Алюминий и медь же являются восстановителями, отдавая свои электроны хлору и претерпевая свои изменения.
Коррозия металлов под влиянием хлора

Хлор является одним из наиболее агрессивных химических веществ, способных вызывать коррозию металлов. Под влиянием хлора многие металлы могут реагировать с оксигеном или гидроксидами, образуя окислы или гидроксиды металлов, что приводит к разрушению материала.
Коррозия металлов под влиянием хлора протекает особенно интенсивно в окружающих средах с высокой концентрацией хлора, таких как морская вода, бассейны, использующие хлор для обеззараживания, а также производства химических веществ и автомобильные дороги, обработанные солевыми реагентами в зимнее время.
Одним из примеров коррозии металлов под влиянием хлора является образование ржавчины на поверхности железного металла при воздействии хлорированной воды. Хлор реагирует с оксигеном в воде, образуя кислородные анионы, которые взаимодействуют с поверхностью металла, вызывая окислительную реакцию и образование ржавчины.
Коррозия металлов под влиянием хлора также может приводить к образованию металлических солей. Например, реакция хлора с алюминием может привести к образованию хлорида алюминия. Такие соли могут накапливаться на поверхности металла и вызывать его разрушение.
Для защиты металлов от коррозии, вызванной контактом с хлором, можно использовать различные методы, такие как нанесение защитных покрытий, использование антикоррозийных материалов или подбор специальных сплавов, устойчивых к коррозии в присутствии хлора.
Применение хлора в промышленности

Хлор широко применяется в различных отраслях промышленности благодаря своим уникальным химическим свойствам. Его окислительно-восстановительные свойства позволяют использовать его во многих процессах.
Одним из основных применений хлора является производство пластмасс. Хлор используется в качестве сырья для производства поливинилхлорида (ПВХ) – одного из самых важных полимеров в мире. ПВХ является гибким, долговечным и устойчивым к различным химическим воздействиям материалом, и широко используется в производстве труб, оконных рам, пленки и других изделий.
Хлор также применяется в процессе получения хлорированного каучука. Хлорируют каучук при помощи хлора и сосредоточенной серной кислоты. Хлорированный каучук имеет высокую стойкость к термическому воздействию, маслам и химическим реагентам, что делает его применимым в производстве прокладок, уплотнений и других резиновых изделий.
Хлор также используется в процессе получения соды – одного из самых важных химических продуктов. Для этого хлорируют натриевую соль, полученную из руды или морской воды. Сода находит применение в многих отраслях промышленности, включая стекольную, водоочистку, производство мыла и моющих средств.
Еще одним применением хлора является его использование в процессе очистки воды. Хлор является мощным окислителем и убивает бактерии и вирусы, присутствующие в водопроводной воде. Он также удаляет неприятный запах и прочие загрязнения, что делает питьевую воду безопасной для употребления.
В заключение, хлор играет важную роль в промышленности благодаря своим уникальным химическим свойствам. Он используется в производстве пластмасс, каучука, соды и играет ключевую роль в очистке воды. Благодаря своей эффективности и доступности, хлор остается одним из важных химических веществ в промышленности.
Вопрос-ответ

Какие металлы реагируют с хлором?
Хлор реагирует со многими металлами, в том числе с щелочными (например, натрием и калием) и щелочноземельными (например, кальцием и магнием) металлами. Он также реагирует с более редкоземельными металлами, такими как алюминий и титан.
Какой процесс происходит при взаимодействии хлора с металлами?
При взаимодействии хлора с металлами происходит окислительно-восстановительная реакция. Хлор выступает в роли окислителя, т.е. при этом процессе он получает электроны от металла и сам уменьшается, а металл выступает в роли восстановителя, отдавая электроны хлору и сам окисляется.
Как можно применить эти свойства хлора в промышленности?
Свойства хлора как окислителя при его взаимодействии с металлами могут быть использованы в промышленности для таких целей, как очистка металлических поверхностей от загрязнений и окислов, производство хлористых металлов и сплавов, а также синтез некоторых органических соединений.
Какие условия могут повлиять на скорость реакции хлора с металлами?
Скорость реакции хлора с металлами зависит от таких условий, как температура, концентрация хлора и металла, поверхность металла, наличие катализаторов и растворителей, а также физическое состояние металла (например, твердое или жидкое).
Могут ли процессы, связанные с взаимодействием хлора с металлами, протекать в газообразной фазе?
Да, реакции между хлором и металлами могут протекать как в твердой, так и в газообразной фазе. Например, при нагревании хлорида натрия с металлическими порошками натрия можно получить диборид натрия в газообразной форме.
