Щелочные металлы являются химически активными элементами с первой группы периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Водородсульфат (H2SO4) - это одна из наиболее распространенных и химически активных кислот, используемых в различных процессах и промышленности. Взаимодействие щелочных металлов с H2SO4 приводит к реакциям, которые отражают их химические свойства и демонстрируют их реакционную способность.
В реакции между щелочными металлами и H2SO4 образуется соль и выделяется водород. При этом ион водорода (H+) замещает щелочной металл, образуя соответствующую соль с химической формулой M2SO4, где M обозначает щелочной металл. Это реакция обмена, известная как нейтрализационная реакция, поскольку она приводит к образованию нейтрального соединения – соли.
Реакция щелочных металлов с H2SO4 сопровождается выделением водорода и образованием горячей смеси солей. Для ускорения реакции можно применить нагрев или использовать металлы в виде порошка или стружки, чтобы увеличить их площадь поверхности и обеспечить лучший контакт с кислотой. Реакция сопровождается также растворением щелочных металлов в кислоте и образованием кислого водородсульфата, которые можно отделить от полученной соли путем дальнейшей обработки или фильтрации.
Свойства щелочных металлов
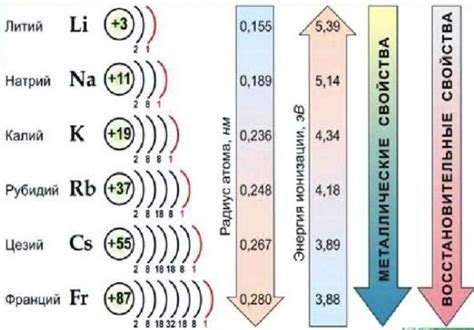
Щелочные металлы – элементы, которые расположены в первой группе периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть ряд характерных свойств, которые делают их уникальными в химическом мире.
Первое свойство щелочных металлов – высокая химическая реактивность. Они легко реагируют с водой, образуя гидроксиды и выделяя водородный газ. Реакция происходит с очень большим выделением тепла, иногда с такой силой, что вода начинает кипеть.
Второе свойство щелочных металлов – низкая плотность. Плотность щелочных металлов ниже плотности большинства других металлов. Например, литий – самый легкий из всех металлов, его плотность составляет всего 0,53 г/см³. Натрий, калий и другие щелочные металлы также обладают низкой плотностью.
Третье свойство щелочных металлов – способность образовывать ионы M+, где M – символ соответствующего металла. В результате реакций с кислородом, щелочные металлы образуют оксиды, например, литий образует оксид Li2O. Эти оксиды легко растворяются в воде, образуя щелочную среду.
Четвертое свойство щелочных металлов – способность образовывать ярко окрашенные соединения. Некоторые соединения щелочных металлов имеют яркую окраску, такие как желтый цезиевый перманганат (CsMnO4) или фиолетовый калийный перманганат (KMnO4). Эти соединения широко используются в аналитической химии.
Таблица 1: Свойства щелочных металлов
| Металл | Расположение в периодической системе | Плотность (г/см³) | Окислительное число |
| Литий (Li) | 3-я период, 1-я группа | 0,53 | +1 |
| Натрий (Na) | 3-я период, 1-я группа | 0,97 | +1 |
| Калий (K) | 4-я период, 1-я группа | 0,86 | +1 |
| Рубидий (Rb) | 5-я период, 1-я группа | 1,53 | +1 |
| Цезий (Cs) | 6-я период, 1-я группа | 1,93 | +1 |
Таким образом, свойства щелочных металлов определяют их уникальное поведение в химических реакциях и находят применение в различных областях, от промышленности до медицины.
Общие характеристики серной кислоты (H2SO4)

Серная кислота (H2SO4) является одной из наиболее распространенных и химически активных кислот. Эта бесцветная жидкость обладает сильной кислотной средой и широко используется в промышленности и лабораторных исследованиях.
Основное свойство серной кислоты - ее кислотность. Она является одним из наиболее кислых веществ, образуя водородные ионы (H+) при диссоциации. Серная кислота также обладает большим ангидридным эффектом и сильно агрессивна по отношению к многим материалам, включая металлы и органические соединения.
Серная кислота легко реагирует с водой, выделяя большое количество тепла. Это свойство называется экзотермической реакцией. При смешении серной кислоты и воды образуется диметилсульфоксид (DMSO), который является отличным растворителем и применяется в различных химических процессах.
Серная кислота также обладает окислительными свойствами и может разлагать многие органические соединения. Она широко применяется в химической промышленности для производства удобрений, пластмасс, красителей и многих других продуктов.
Взаимодействие лития с H2SO4

Литий - мягкий щелочной металл, который взаимодействует с H2SO4, образуя сульфат лития и выделяяся водород. Реакция является экзотермической и характеризуется выделением огня и плавления лития.
Во время взаимодействия лития с H2SO4 образуется сульфат лития (Li2SO4) и выделяется водород (H2). Сама реакция представляет собой реакцию нейтрализации щелочного металла и кислоты.
Уравнение реакции взаимодействия лития с H2SO4 можно представить следующим образом:
2Li + H2SO4 → Li2SO4 + H2 ↑
В водородной реакции высвобождается газ, и он может быть замечен по пузырькам, возникающим во время проведения эксперимента. Выделение водорода сопровождается высокими температурами и иногда открытым пламенем.
Литийная реакция с H2SO4 является очень оживленной и может быть опасной при неправильном выполнении. Поэтому необходимо соблюдать все меры предосторожности при проведении эксперимента и работе с литием и концентрированной серной кислотой.
Взаимодействие натрия с H2SO4

Натрий – щелочной металл, с химическим символом Na и атомным номером 11, реагирует с раствором серной кислоты (H2SO4) проявляя ряд химических свойств. В ходе реакции образуется натрий сульфат (Na2SO4) и высвобождается газовый продукт – диоксид серы (SO2).
Реакция между натрием и серной кислотой является экзотермической, то есть сопровождается выделением тепла. Для проведения данной реакции необходимо добавить натрий в раствор H2SO4 и осторожно контролировать температуру. При нагревании реакционной смеси наблюдается интенсивное шипение и образование пенящегося белого вещества – сульфата натрия.
В ходе реакции натрий энергично реагирует с серной кислотой, вытесняя из нее водород. Этот процесс происходит с выделением большого количества энергии и возникновением пламени. При взаимодействии натрия с H2SO4 рекомендуется соблюдать осторожность и проводить опыт в специально оборудованной лаборатории с применением защитных средств.
Взаимодействие калия с H2SO4
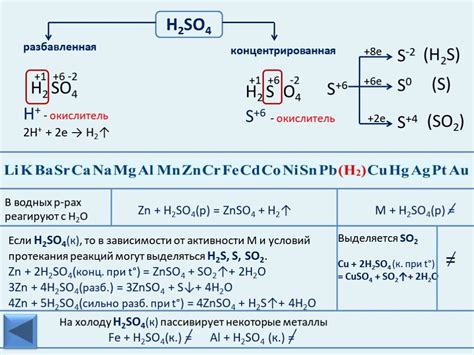
Взаимодействие калия с серной кислотой (H2SO4) является одним из примеров реакции щелочных металлов с кислотами. При смешении калия с H2SO4 происходит реакция, в результате которой образуется сульфат калия (K2SO4) и выделяется водородный газ (H2).
Реакция калия с H2SO4 протекает с выделением большого количества тепла и является экзотермической. Взаимодействие калия с кислотой происходит очень быстро и сопровождается плавким покраснением металла. Данная реакция является очень опасной из-за возможности вспышки и выбросов горящего водорода.
Сульфат калия (K2SO4), образующийся в результате реакции, представляет собой белый кристаллический порошок, применяемый в различных отраслях промышленности. Он широко используется в сельском хозяйстве в качестве удобрения, а также в производстве стекла, моющих средств, пластмасс и других продуктов.
Водородный газ (H2), выделяющийся в результате реакции калия с H2SO4, является горючим и может взрываться в присутствии открытого огня или источника искры. Поэтому при проведении данной реакции необходимо соблюдать меры предосторожности и использовать защитные средства.
Взаимодействие рубидия с H2SO4

Рубидий (Rb) – щелочной металл, принадлежащий к группе I периодической системы элементов. Он обладает высокой реакционной способностью, способен взаимодействовать с рядом кислот, включая серную кислоту (H2SO4).
При контакте рубидия с H2SO4 происходит реакция образования соответствующего соли и выделения водорода. Это связано с тем, что рубидий является более активным металлом, чем водород, поэтому он вытесняет его из связи с кислородом.р>
Уравнение реакции между рубидием и серной кислотой выглядит следующим образом:р>
2Rb + H2SO4 → Rb2SO4 + 2H2
В результате реакции образуется рубидийсульфат (Rb2SO4), прочный и хорошо растворимый в воде. Выделение молекул водорода (H2) содействует бурной реакции, часто сопровождающейся появлением пламени и пузырьков. Реакция протекает при нагревании и при обычной температуре.р>
Взаимодействие рубидия с серной кислотой является типичной реакцией для щелочных металлов. Оно позволяет использовать рубидий и другие металлы этой группы в различных химических и технических процессах, а также в производстве специальных соединений и препаратов.р>
Взаимодействие цезия с H2SO4
Взаимодействие цезия с серной кислотой (H2SO4) является экзотермической реакцией, при которой образуется сульфат цезия (Cs2SO4) и выделяется вода и диоксид серы.
Реакция протекает достаточно быстро и с высокой степенью интенсивности. Цезий, как щелочной металл, обладает высокой активностью и легко реагирует с кислотами. В результате взаимодействия цезия с H2SO4 образуется обильное выделение паров диоксида серы, а также небольшое количество газообразного водорода.
Сульфат цезия (Cs2SO4) образует бесцветные кристаллы, которые хорошо растворяются в воде. Это безвкусное и беззапаховое вещество, которое широко используется в различных научных и промышленных областях.
Взаимодействие цезия с H2SO4 является типичной реакцией, проявляющей сходство с реакциями других щелочных металлов с кислотами. Однако цезий обладает особыми свойствами, такими как низкая ионизационная энергия и высокая реакционная способность, что делает его интересным объектом исследования в химической науке.
Области применения взаимодействий щелочных металлов с H2SO4
Взаимодействие щелочных металлов с H2SO4 имеет широкий спектр применения в различных областях научных и промышленных исследований.
Одной из главных областей применения этих реакций является химическая промышленность. Щелочные металлы, такие как натрий и калий, генерируют большое количество тепла при взаимодействии с H2SO4, что их делает идеальными для использования в процессах нагревания и нагревательных системах. Также эти реакции являются важными для синтеза различных химических соединений, включая соли и органические соединения.
Взаимодействие щелочных металлов с H2SO4 также активно применяется в аналитической химии. Реакции с H2SO4 позволяют производить дифференциальное определение щелочных металлов в присутствии других ионов. Это полезно, например, для определения содержания ионов натрия и калия в почве или пищевых продуктах.
Кроме того, взаимодействие щелочных металлов с H2SO4 играет роль в электрохимических систеах. Натрий и калий часто используются в качестве электролитов в батареях и аккумуляторах. При этом происходит электрохимическая реакция, в ходе которой щелочные металлы окисляются, а H2SO4 восстанавливается. Эти реакции основаны на принципах электролиза и позволяют хранить и выделять энергию.
Таким образом, взаимодействие щелочных металлов с H2SO4 является важным и широко применяемым процессом в различных областях науки и промышленности, включая химическую промышленность, аналитическую химию и электрохимические системы.
Вопрос-ответ

Какие свойства имеет реакция между щелочными металлами и H2SO4?
Реакция между щелочными металлами (натрием, калием, литием) и H2SO4 является одной из наиболее активных реакций с кислотами. При взаимодействии щелочных металлов с H2SO4 образуется соль соответствующего щелочного металла и сульфатная кислота. В результате реакции образуется большое количество теплоты и данная реакция сопровождается выделением газа (обычно это водород).
Какие реакции происходят при взаимодействии натрия с H2SO4?
При взаимодействии натрия с H2SO4 происходит реакция окисления натрия и восстановления серной кислоты. В результате реакции образуется натрий сульфат и выделяется водородный газ. Уравнение реакции выглядит следующим образом: 2Na (s) + H2SO4 (aq) → Na2SO4 (aq) + H2 (g).
Каким образом реагирует калий с H2SO4?
При взаимодействии калия с H2SO4 происходит аналогичная реакция, как и с натрием. Калий окисляется, серная кислота восстанавливается, и образуется калий сульфат и водородный газ. Уравнение реакции выглядит следующим образом: 2K (s) + H2SO4 (aq) → K2SO4 (aq) + H2 (g).
Какую соль можно получить при взаимодействии лития с H2SO4?
При взаимодействии лития с H2SO4 образуется литий сульфат. Уравнение реакции выглядит следующим образом: 2Li (s) + H2SO4 (aq) → Li2SO4 (aq) + H2 (g).
