Соли щелочных металлов - это соединения, образованные путем реакции металлических щелочных элементов с кислотами. Эти элементы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Соли щелочных металлов обладают рядом характеристических свойств. Они обычно имеют высокую температуру плавления и кипения, что связано с их ионным характером. Они растворяются в воде и образуют щелочные растворы, которые хорошо проводят электричество. Кроме того, соли щелочных металлов могут образовывать кристаллы, которые обладают регулярной решеткой и могут быть использованы в различных технических и химических процессах.
Одной из наиболее распространенных солей щелочных металлов является хлорид натрия (NaCl), который широко применяется в пищевой промышленности, медицине и в различных технологических процессах. Другими примерами солей щелочных металлов являются карбонат натрия (Na2CO3), гидроксид натрия (NaOH) и ацетат натрия (CH3COONa). Каждая из этих солей имеет свои уникальные свойства и широко используется в различных отраслях промышленности и научных исследованиях.
В заключение, соли щелочных металлов являются важными химическими соединениями, которые имеют широкий спектр применения. Их характеристики и свойства делают их полезными в решении различных задач в науке, промышленности и медицине.
Соли щелочных металлов: особенности и свойства
Соли щелочных металлов - это химические соединения, образующиеся при реакции основного одновременно с кислотой. Они обладают рядом характеристических особенностей и свойств, которые делают их важными в различных областях науки и промышленности.
Во-первых, соли щелочных металлов являются хорошими проводниками электричества. Это связано с наличием в их структуре свободных ионов, которые способствуют перемещению зарядов. На основе солей щелочных металлов можно создавать электролиты, которые применяются в батареях, аккумуляторах и других устройствах для хранения и передачи энергии.
Во-вторых, соли щелочных металлов обладают высокой растворимостью в воде. Это делает их легко доступными для использования в различных процессах, связанных с химической реакцией в растворе. Кроме того, многие соли щелочных металлов обладают способностью образовывать кристаллы при высокой концентрации, что делает их интересными для исследования структуры кристаллов и свойств материалов.
В-третьих, соли щелочных металлов обладают специфическими химическими и физическими свойствами. Например, некоторые соли натрия и калия используются в пищевой промышленности в качестве консервантов и добавок для придания определенного вкуса продуктам. Кроме того, соли лития применяются в производстве аккумуляторных батарей, так как они обладают высокой плотностью энергии и длительным сроком службы.
Щелочные металлы: общая характеристика

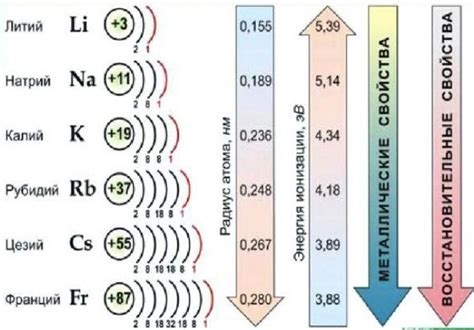
Щелочные металлы – это элементы, которые находятся в первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Рb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой химической активностью и обладают металлическим блеском. Они мягкие, легко режутся ножом и имеют низкую плотность.
Атомы щелочных металлов имеют одну валентную электронную оболочку, что делает их реакционно способными. Они активно реагируют с водой, кислородом и галогенами, образуя щелочные оксиды или галогениды. Например, расположение щелочных металлов в воде приводит к образованию щелочных растворов и выделению водорода.
Щелочные металлы имеют низкую электроотрицательность и легко образуют положительные ионы. Они служат хорошими восстановителями и используются в различных процессах и технологиях. Например, калий используется в производстве удобрений, натрий – в стекольной промышленности, а литий – в производстве аккумуляторов.
- Литий (Li) – наименее реакционно способный из щелочных металлов, обладает наибольшей плотностью и наименьшим радиусом.
- Натрий (Na) – мягкий и легкий металл, широко используется в пищевой промышленности, а также в производстве стекла и моющих средств.
- Калий (K) – активный металл, используется в производстве удобрений, взрывчатых веществ и в различных химических реакциях.
- Рубидий (Рb) – мягкий и реакционно способный металл, применяется в производстве волоконно-оптических кабелей.
- Цезий (Cs) – наиболее реакционно способный щелочный металл, используется в электронике и ядерной энергетике.
- Франций (Fr) – крайне реакционный щелочный металл, является радиоактивным и имеет крайне малую продолжительность жизни.
Щелочные металлы играют важную роль в многих отраслях промышленности и научных исследованиях. Их химические свойства и способность образовывать ионы делают их востребованными элементами в различных процессах, таких как производство стекла, аккумуляторов, удобрений и других продуктов.
Вопрос-ответ

Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какова общая характеристика солей щелочных металлов?
Соли щелочных металлов обладают характерными свойствами: они растворяются в воде, образуя щелочные растворы, имеют высокую термическую устойчивость, кристаллическую структуру и хорошую проводимость электричества.
Какие основные свойства имеют соли щелочных металлов?
Соли щелочных металлов имеют следующие основные свойства: они образуют бесцветные или окрашенные кристаллы, обладают высокой термической устойчивостью, а также хорошей растворимостью в воде. Они обычно обладают щелочной реакцией и хорошо проводят электричество в расплавленном и растворенном состоянии. Кроме того, они обычно образуют гидраты и могут образовывать двойные соли с различными анионами.
