Степень окисления водорода – это числовое значение, показывающее количество электронов, которые вода теряет или получает при взаимодействии с другими веществами. Данный показатель является важным фактором для определения электрохимических свойств веществ и их реакционной активности. При взаимодействии водорода с металлами степень его окисления может быть различной.
Окисление водорода в соединениях с металлами может происходить при образовании ионов водорода H+. Однако стоит отметить, что водород способен образовывать ионы с отрицательной степенью окисления, которые называют гидридами. Гидриды металлов являются химически активными веществами, обладающими различными свойствами и способностями к реакциям.
Примерами соединений металлов с окислением водорода являются гидриды. Например, натрий образует гидрид натрия (NaH), в котором водород имеет отрицательную степень окисления. Алюминий также может образовывать гидрид, но уже с положительной степенью окисления. В данном случае гидрид алюминия (AlH3) является бораном, который обладает высокой реакционной активностью.
Особенности и примеры степени окисления водорода в соединениях металлов
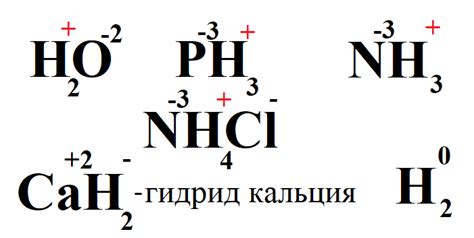
Степень окисления водорода в соединениях с металлами может варьироваться в зависимости от ряда факторов, включая тип металла, его валентность и окружающую среду. Водород может выступать как катион с положительной степенью окисления, так и анионом с отрицательной степенью окисления. Это делает его уникальным элементом в химических реакциях соединений металлов.
Примером соединения с положительной степенью окисления водорода является металлический гидрид. В этом случае, водород принимает электроны от металла и формирует отрицательный ион гидрида. Примером такого соединения является LiH, где литий имеет степень окисления +1, а водород -1.
С другой стороны, водород может также образовывать соединения с отрицательной степенью окисления, как например, гидриды щелочных металлов. В этих соединениях, водород выступает в роли катиона. Например, в гидриде натрия (NaH), натрий имеет степень окисления +1, а водород +1.
Степень окисления водорода в соединениях металлов также может быть связана с его окружающей средой. Например, при взаимодействии водорода с кислородом образуется вода (H2O), где водород имеет степень окисления +1, а кислород -2.
В заключение, степень окисления водорода в соединениях металлов является важным фактором, который определяет его электронные свойства и его роль в химических реакциях. Изучение этих особенностей помогает лучше понять химическую природу соединений металлов и развивать новые материалы с уникальными свойствами.
Степень окисления водорода в металлических соединениях

Степень окисления водорода в металлических соединениях может быть различной и зависит от его взаимодействия с конкретным металлом.
В качестве ионного компонента металлических соединений водород обычно имеет положительное окисление. Это связано с тем, что водород активно уступает свои электроны металлу, что приводит к образованию положительно заряженных ионов водорода, или протонов.
Однако есть исключения, например в соединениях с металлами из группы 1 периодической системы, такими как литий и натрий, водород может оставаться в нейтральном состоянии. В этом случае металл сохраняет свою положительную зарядку, а водород не участвует в обмене электронами и не приобретает заряд. Такие соединения называются гидридами.
Важно отметить, что степень окисления водорода в металлических соединениях может варьироваться в зависимости от условий реакции и типа взаимодействия металла с водородом. Например, в соединениях с переходными металлами степень окисления водорода может быть различной и зависеть от конкретного окружающего окислителя или восстановителя.
Вопрос-ответ

Какова степень окисления водорода в соединениях с металлами?
Степень окисления водорода в соединениях с металлами может быть различной и зависит от условий реакции. Однако чаще всего водород имеет степень окисления +1 в соединениях с металлами.
Какие металлы могут образовывать соединения с водородом и что это за соединения?
Многие металлы способны образовывать соединения с водородом. Например, некоторые из них образуют соединения типа гидридов, где водород имеет степень окисления -1. К таким металлам относятся, например, литий (LiH), натрий (NaH), калий (KH) и другие щелочные металлы. Также некоторые металлы могут образовывать соединения типа бинарных гидридов, где водород имеет степень окисления -2. К этой группе металлов относятся, например, магний (MgH2), алюминий (AlH3) и титан (TiH2).
Какие особенности связаны со степенью окисления водорода в соединениях с металлами?
Степень окисления водорода в соединениях с металлами определяет его сродство к электронам и активность в реакциях. Например, соединения с водородом, где водород имеет степень окисления -1, обладают высокой активностью и могут быть использованы в качестве источников водорода. Также в соединениях с водородом металлы могут образовывать гидридные фазы, которые имеют важное значение в различных областях, например, в электрохимии и материаловедении.
