Атомы металлов представляют собой основные строительные блоки, из которых состоят все металлические материалы. Эти атомы имеют уникальное строение и свойства, которые делают металлы одними из наиболее полезных и важных материалов в мире. Понимание строения атомов металлов позволяет нам более глубоко изучать их свойства и поведение в различных условиях.
Строение атомов определяется их электронной структурой. Каждый атом металла состоит из ядра, образованного протонами и нейтронами, и орбитальной оболочки, на которой движутся электроны. Основным свойством металлов является наличие свободных электронов, которые могут легко перемещаться по сети атомов. Именно благодаря этим свободным электронам металлы обладают высокой электропроводностью и теплопроводностью.
Различные металлы имеют разное количество электронов в своих атомах. Например, медь имеет 29 электронов в своей внешней оболочке, а железо - 26. Это различие в электронной структуре обусловливает разные свойства и поведение этих металлов. Некоторые металлы, такие как золото, имеют очень устойчивую электронную структуру и не окисляются воздухом. Другие металлы, например, алюминий, образуют защитную окисную пленку, которая предотвращает дальнейшую коррозию.
Строение атомов металлов также влияет на их способность образовывать кристаллическую решетку. Кристаллическая решетка - это регулярное трехмерное расположение атомов в кристалле. Различные типы металлов имеют разные структуры решетки, такие как гранецентрированная кубическая решетка или шестигранная ближайшей упаковки. Структура решетки и форма атомов металлов влияют на их механические, термические и электрические свойства.
Общее строение атомов металлов
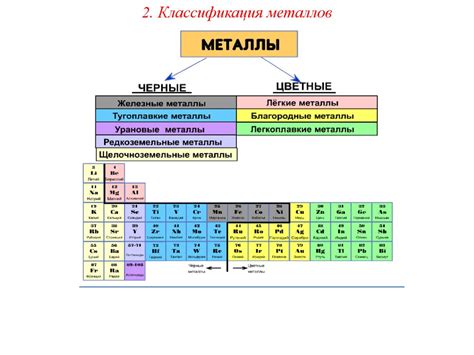
Атомы металлов являются основными строительными блоками металлических материалов. Они обладают особенностями в своей структуре, которые определяют их химические и физические свойства.
Атомы металлов состоят из ядра и электронов. Ядро атома содержит протоны и нейтроны, которые обеспечивают массу атома и его положительный заряд. Электроны, в свою очередь, находятся вокруг ядра и обеспечивают отрицательный заряд атома.
Одной из основных особенностей атомов металлов является наличие свободных электронов. Это связано с тем, что у металлов внешний электронный слой не полностью заполнен, что делает его более подвижным и способным образовывать металлические связи. Это обуславливает такие важные свойства металлов, как хорошая электропроводность и теплопроводность.
Структура атомов металлов также варьируется в зависимости от их положения в периодической таблице. Например, в основной группе металлов, атомы имеют небольшой размер и их внешний электронный слой состоит из 1-2 электронов. В переходных металлах, в свою очередь, атомы имеют больший размер и их внешний электронный слой состоит из нескольких электронов.
Общее строение атомов металлов может быть представлено в виде таблицы, в которой указана их химическая формула, массовое число, атомный радиус и количество электронов в различных энергетических оболочках.
Строение атома железа
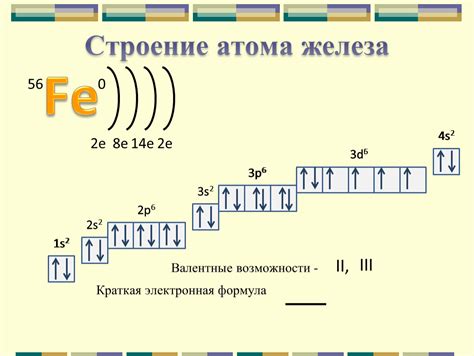
Атом железа состоит из ядра и электронной оболочки. Ядро атома железа содержит протоны и нейтроны, которые называются нуклонами. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Электронная оболочка атома железа состоит из электронов, которые имеют отрицательный заряд и обращаются вокруг ядра по определенным орбитам.
Число протонов в ядре атома железа называется атомным номером и определяет его химические свойства. У атома железа атомный номер равен 26, что указывает на наличие 26 протонов в ядре. Нуклонное число атома железа равно сумме протонов и нейтронов в ядре. Для железа нуклонное число равно примерно 56.
Внешняя электронная оболочка атома железа содержит 2 электрона на первом энергетическом уровне и 8 электронов на втором энергетическом уровне. Это означает, что у атома железа всего 26 электронов и они распределены по разным уровням энергии. Строение электронной оболочки определяет взаимодействие атома железа с другими атомами и его способность образовывать химические соединения.
Строение атома железа можно представить в виде схемы с электронной оболочкой и ядром. На схеме можно показать распределение электронов по энергетическим уровням и их взаимное взаимодействие. Такая схема помогает увидеть особенности строения и свойства атома железа.
Строение атома алюминия
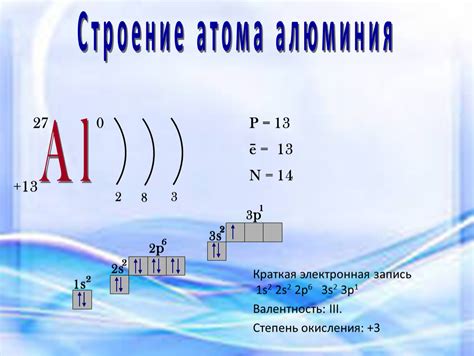
Алюминий (Al) — это легкий металл, который находится в третьей группе периодической таблицы. Атом алюминия состоит из ядра и электронной оболочки.
Ядро алюминия содержит 13 протонов и 14 нейтронов, что обеспечивает атому алюминия атомный номер 13. Протоны положительно заряжены, а нейтроны не имеют заряда, поэтому общая заряд атомного ядра алюминия равна 13 положительным единицам.
Вокруг ядра алюминия располагается электронная оболочка, которая содержит 13 электронов. Электроны отрицательно заряжены и движутся по орбитальным путям вокруг ядра. Электронная оболочка алюминия имеет следующую электронную конфигурацию: 1s2 2s2 2p6 3s2 3p1.
Атом алюминия имеет 13 электронов, что соответствует количеству протонов в ядре. Внешний электрон алюминия находится на третьей энергетической оболочке и представлен в обозначении 3p1. Это делает алюминий химически активным элементом, готовым вступать в химические реакции для завершения своей электронной оболочки.
Строение атома алюминия обеспечивает ему устойчивость и свойства, которые делают его полезным для различных применений. Алюминий используется в промышленности и строительстве благодаря своей легкой весу, хорошей теплопроводности и способности образовывать оксидную пленку, защищающую металл от окисления.
Строение атома меди
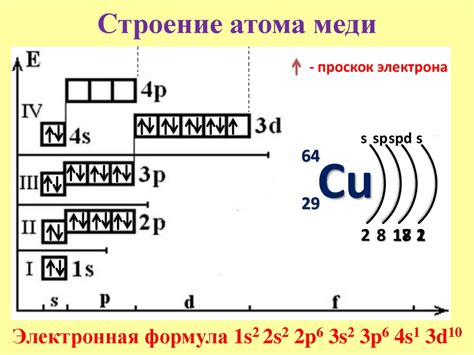
Медь - это металл, который находится в периодической таблице элементов под номером 29. Его атомный номер - 29, а атомная масса - 63,55. Строение атома меди обусловлено его электронной оболочкой и ядерными частицами.
Атом меди состоит из нейтральных частиц - нейтронов и протонов, образующих ядро атома. Протоны имеют положительный заряд, равный единице, как и атомный номер меди, а нейтроны не имеют электрического заряда. Отношение числа протонов к числу нейтронов в ядре определяет стабильность атома меди.
Вокруг ядра меди располагается электронная оболочка, на которой находятся электроны. Количество электронов в атоме меди равно числу протонов и атомному номеру - 29. Каждый электрон обладает отрицательным зарядом и движется по своим орбитам, образуя электронные облака или орбитали.
Строение атома меди можно представить в виде следующей таблицы:
| Частица | Количество |
|---|---|
| Протоны | 29 |
| Нейтроны | 34 |
| Электроны | 29 |
Строение атома меди также определяет его химические свойства и способность вступать в различные химические реакции. Это делает медь одним из важных элементов для промышленности и производства различных изделий.
Строение атома свинца
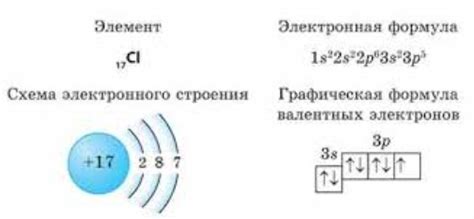
Свинец - химический элемент с атомным номером 82, обозначается символом Pb. Он относится к группе элементов, известных как постпериодические металлы, и является тяжелым металлом.
Атом свинца состоит из ядра, которое содержит протоны и нейтроны, окруженного электронной оболочкой. Ядро атома свинца состоит из 82 протонов и различного числа нейтронов, в зависимости от изотопа. Наиболее стабильный изотоп имеет 126 нейтронов.
Внешняя электронная оболочка атома свинца содержит 6 электронов, распределенных по различным энергетическим уровням. Свинец имеет конфигурацию электронной оболочки 5d10 6s2 6p2, что означает, что у него есть 2 электрона на s-орбитали, 2 электрона на p-орбитали и 10 электронов на d-орбитали.
Изотопы свинца имеют различные массы и структуры ядра, что делает их полезными для различных приложений. Например, изотоп свинца-210 используется в радиоэкологии для изучения перемещения свинца в природных системах, а изотоп свинца-206 используется в геохимии для определения возраста горных пород и минералов.
Строение атома цинка

Цинк (Zn) является химическим элементом, атомы которого характеризуются своим уникальным строением. Атом цинка состоит из ядра и электронов, которые образуют оболочки вокруг ядра. Ядро атома цинка содержит протоны, которые имеют положительный заряд, и нейтроны, которые не имеют заряда. Они находятся в центре атома и представляют его основную массу.
Вокруг ядра атома цинка вращаются электроны. Электроны имеют отрицательный заряд и образуют оболочки с разным энергетическим уровнем. Первая электронная оболочка наиболее близка к ядру и может вместить только два электрона. Вторая оболочка может вместить до восьми электронов, а третья оболочка может вместить до восемнадцати электронов.
Атом цинка обладает атомным номером 30, что означает, что он содержит 30 протонов в своем ядре. Количество электронов в атоме цинка также равно 30, что делает его электрически нейтральным. Внешняя оболочка атома цинка содержит 2 электрона, что указывает на его валентность и его химическое поведение в реакциях.
Строение атома цинка определяет его химические свойства и его взаимодействие с другими элементами. Металл цинк широко используется в промышленности и в нашей повседневной жизни благодаря своим уникальным свойствам и строению его атомов.
Вопрос-ответ

Какое строение имеют атомы металлов?
Атомы металлов имеют кристаллическую структуру, которая характеризуется упорядоченным расположением атомов в решетке.
Что такое кристаллическая решетка металлов?
Кристаллическая решетка металлов представляет собой трехмерную упорядоченную структуру, в которой атомы металла занимают определенные позиции.
Какие особенности в строении атомов металлов определяют их свойства?
Основные особенности в строении атомов металлов, определяющие их свойства, это свободные электроны, которые способны перемещаться между атомами и образовывать электронный газ, и кристаллическая решетка, обеспечивающая металлическую связь и характерные физические и химические свойства металлов.
