Атомы металлов и неметаллов составляют основу всех химических элементов. Они имеют различное строение, которое определяет их свойства и характеристики. Металлы и неметаллы отличаются как внутренним строением своих атомов, так и взаимодействием с другими элементами и соединениями.
Атомы металлов обладают особыми свойствами, которые делают их отличными от неметаллов. Основным отличием металлов является наличие свободных электронов во внешней оболочке атома. Это позволяет металлам образовывать атомарные связи друг с другом и образовывать металлическую решетку.
Атомы неметаллов, в свою очередь, имеют своеобразное строение. В отличие от металлов, они не имеют свободных электронов во внешней оболочке, поэтому образуют координатные или ковалентные связи с другими атомами. Неметаллы обычно образуют молекулы, состоящие из двух или более атомов.
Металлы и неметаллы также отличаются во многих других аспектах, включая температуру плавления и кипения, плотность, твердость и электропроводность. Но их различия начинаются с самого строения атома и определяют фундаментальные различия в их химических и физических свойствах.
Строение атомов металлов

Атомы металлов отличаются от атомов неметаллов особенной структурой, которая является одной из причин их металлических свойств.
В атоме металла большинство электронов расположены во внешних электронных оболочках, которые называются валентными оболочками. Валентная оболочка включает в себя одну или несколько энергетических уровней, на которых находятся электроны, способные легко участвовать в химических реакциях. Поэтому именно эти электроны сильно влияют на металлические свойства материала.
Строение атомов металлов можно представить в виде решетки, в которой ядро атома расположено в центре, а вокруг него находятся электроны, заполняющие энергетические уровни. Внешние электроны, находящиеся на валентной оболочке, имеют возможность движения вокруг большого числа атомов, образуя свободные электроны. Именно свободные электроны отвечают за проводимость электричества и теплоты в металлах, а также за их блеск и обработку металлов.
Строение атомов металлов также обуславливает их способность образовывать ионные решетки при образовании металлических соединений. Ионы металла в ионной решетке упорядочены, а между ними находятся свободные электроны, которые могут передвигаться по решетке и обеспечивать проводимость электричества.
Основные черты и компоненты
Строение атома металла:
- Кристаллическая решетка, которая характеризуется регулярным расположением атомов.
- Металлическая связь, в которой электроны образуют общую электронную оболочку и свободно передвигаются по всей решетке.
- Технический металл представляет собой большую совокупность атомов, объединенных в определенную структуру.
Строение атома неметалла:
- Ковалентная связь, в которой атомы неметалла обменивают электроны, чтобы достичь полностью заполненных внешних энергетических уровней.
- Атомы неметалла имеют различные силы притяжения, поэтому их связи могут быть как полностью ковалентными, так и иметь ионный характер или быть полярными.
- Неметалл может существовать в разных аллотропных формах, таких как графит и алмаз у углерода.
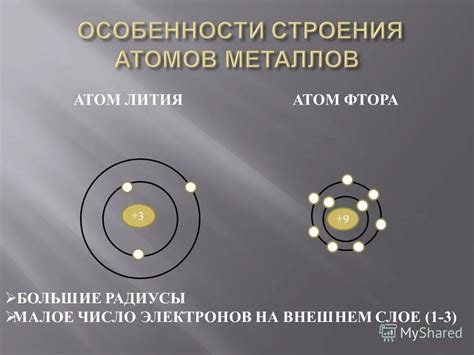
Особенности атомов металлов:
- Металлические атомы обладают слабой силой притяжения своих электронов к ядру, из-за чего они имеют больший радиус и малую электроотрицательность.
- Металлы обладают высокой электропроводностью, теплопроводностью и блеском из-за свободного движения электронов.
- Металлы могут образовывать ионы с положительным зарядом, отдавая один или несколько своих электронов.
Особенности атомов неметаллов:
- Неметаллические атомы имеют более сильную силу притяжения своих электронов к ядру, из-за чего они имеют меньший радиус и большую электроотрицательность.
- Неметаллы обладают низкой электропроводностью, теплопроводностью и не обладают блеском.
- Неметаллы могут образовывать ионы с отрицательным зарядом или обмениваться электронами с другими атомами неметаллов для образования молекул с ковалентной связью.
Электронная оболочка и ее роль
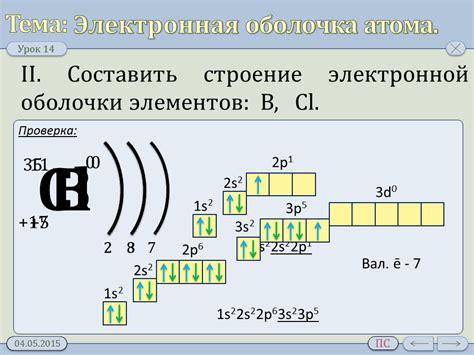
Электронная оболочка атома – это внешняя часть атома, состоящая из электронов, которые образуют электронные орбитали. Она играет важную роль в химическом поведении атомов, определяя их свойства и взаимодействие с другими атомами и молекулами.
На электронную оболочку влияет количество и распределение электронов. В металлах электронная оболочка имеет специфическую структуру, в которой внешняя оболочка содержит свободные электроны, способные двигаться и образовывать электронный газ. Это обуславливает металлические свойства, такие как электропроводность и теплопроводность.
С другой стороны, в неметаллах электронная оболочка организована таким образом, что электроны в ней тесно связаны с атомом и не могут свободно перемещаться. Это объясняет их неметаллические свойства, такие как хрупкость и низкая электропроводность.
Количество электронов в электронной оболочке также определяет химические свойства атома. Атомы металлов обычно имеют меньшее количество электронов во внешней оболочке, что делает их более склонными к отдаче электронов и образованию положительных ионов. Наоборот, атомы неметаллов имеют более высокое количество электронов во внешней оболочке, что делает их более склонными к приему электронов и образованию отрицательных ионов.
Таким образом, электронная оболочка играет ключевую роль в определении химических и физических свойств атомов металлов и неметаллов, делая их уникальными и определяющими их поведение в химических реакциях и применение в различных областях науки и техники.
Строение атомов неметаллов
Атомы неметаллов обладают отличительными особенностями в своем строении. Они имеют более сложную структуру по сравнению с атомами металлов и обладают большим количеством электронов.
Основным строительным блоком атома неметалла является ядро, в котором находятся протоны и нейтроны. Протоны обладают положительным зарядом, а нейтроны не имеют заряда. Вокруг ядра располагаются электроны, которые обращаются по энергетическим оболочкам.
Наиболее близка к ядру первая энергетическая оболочка, на которой может находиться только 2 электрона. Вторая оболочка имеет больший радиус и вмещает до 8 электронов. Третья оболочка уже может вмещать до 18 электронов. Такое упорядоченное распределение электронов в оболочках позволяет неметаллам образовывать химически стабильные соединения.
Электроны в неметаллах могут образовывать различные связи с другими атомами. Из этого следует, что неметаллы обладают разнообразными оптическими и электронными свойствами. Кроме того, атомы неметаллов часто образуют такие структуры, как молекулы, в которых атомы соединены с помощью химических связей.
Отличия от атомов металлов
Связь между атомами:
В атомах неметаллов преобладает ковалентная связь, которая образуется между атомами путем обмена электронами. Ковалентная связь характеризуется равным участием электронов обоих атомов в образовании общего электронного окружения. В металлах присутствует металлическая связь, которая образуется благодаря "морю" электронов в металлической решетке. В этой связи атомы сливаются в однородное облако, образуя так называемые "свободные электроны", которые делятся между всеми атомами.
Электронное строение:
Атомы неметаллов имеют неполный электронный оболочки, что приводит к образованию связи с другими атомами. Например, атом кислорода имеет 6 электронов в валентной оболочке и может принять еще 2 электрона от других атомов, чтобы достичь электронной конфигурации инертного газа. В отличие от этого, атомы металлов имеют полный внешний энергетический уровень, что делает их стабильными. Это позволяет металлам образовывать положительные ионы, отдавая свои внешние электроны.
Физические свойства:
Металлы обладают хорошей проводимостью тепла и электричества, благодаря наличию свободных электронов в своей структуре. Они также обладают высокой пластичностью и прочностью, что делает их идеальными материалами для различных промышленных приложений. Неметаллы, напротив, обычно являются плохими проводниками тепла и электричества. Они обладают хрупкостью и низкой пластичностью, что делает их менее прочными по сравнению с металлами.
Вопрос-ответ

Какова основная разница в строении атомов металлов и неметаллов?
Основная разница в строении атомов металлов и неметаллов связана с расположением их внешних электронных оболочек. У атомов металлов внешняя электронная оболочка отличается от полностью заполненной внутренней оболочки, что делает их готовыми отдавать электроны во внешнюю среду. У атомов неметаллов внешняя электронная оболочка либо полностью заполнена, либо почти, что делает их способными принимать электроны от других атомов. Это различие ведет к определенным химическим и физическим свойствам металлов и неметаллов.
Какие особенности строения атомов металлов можно выделить?
Атомы металлов характеризуются наличием большого количества внешних электронов, обычно от одного до трех. Они разделены на две группы: щелочные металлы и щелочноземельные металлы. Щелочные металлы имеют один электрон во внешней оболочке, а щелочноземельные металлы имеют два электрона. Это делает их очень реактивными и склонными к образованию ионов положительного заряда. Наличие свободных электронов в металлах также способствует их проводимости тепла и электричества.
Какие особенности строения атомов неметаллов можно выделить?
Атомы неметаллов характеризуются наличием внешней электронной оболочки, которая либо полностью заполнена, либо почти полностью заполнена электронами. Это делает их склонными принимать электроны от других атомов и образовывать отрицательно заряженные ионы. Неметаллы обычно имеют более высокую электроотрицательность, чем металлы, что делает их хорошими недостатками электронов. Наличие внешних электронов с высокой электроотрицательностью позволяет неметаллам образовывать ковалентные связи и обладать различными физическими и химическими свойствами, такими как неметаллический блеск и непроводимость электричества.
