Щелочные металлы, такие как литий, натрий, калий и др., являются химической группой элементов, которые обладают рядом общих свойств. Однако, существует дискуссия относительно строения щелочных металлов: являются ли они молекулярными соединениями или в них присутствует ионная связь. Для понимания этой проблемы необходимо рассмотреть их строение и внутренний строительный блок.
Щелочные металлы обладают всего одной электронной оболочкой, которая легко отделяется, образуя положительный ион. В молекулярных соединениях щелочных металлов можно обнаружить их связь с отрицательными ионами. Однако, ионная связь значит, что между атомами происходит перераспределение электронов и атомы образуют кристаллическую решетку.
Большинство свойств щелочных металлов свидетельствует о наличии ионной связи. Они образуют гигроскопичные, полыхидроидные и щелочные соединения, что указывает на наличие в них ионного характера связи. Однако, иногда данным металлам свойственны молекулярные соединения, которые образуются в результате реакций с другими элементами. Именно эти комплексы и вызывают споры относительно строения щелочных металлов.
Строение щелочных металлов
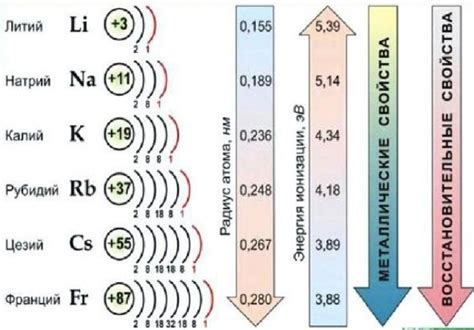
Щелочные металлы – это группа элементов периодической таблицы, состоящая из лития, натрия, калия, рубидия, цезия и франция. Они относятся к I группе периодической системы и характеризуются высокой активностью, низкой электроотрицательностью и низкой плотностью.
Строение щелочных металлов имеет свою особенность – они образуют ионы с положительным зарядом, так как легко отдают один электрон из своей валентной оболочки. В результате, у них нарушено электронное строение, и они обладают особой реакционностью.
Щелочные металлы обычно имеют кубическую кристаллическую структуру, но могут принимать и другие формы. Их атомы располагаются в сетке, в которой каждый атом окружен шестью ближайшими соседями. Это объясняет высокую пластичность и мягкость этих металлов.
Также щелочные металлы обладают низкой температурой плавления и кипения, что делает их очень характерными и удобными для применения в различных областях. Они широко используются в промышленности, медицине и технологии, например, в производстве щелочных батарей или в качестве рабочей среды в ядерных реакторах.
Щелочные металлы: химические элементы

Щелочные металлы представляют собой группу химических элементов, включающую либо литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), либо только последние пять из них. Они расположены в первой группе периодической системы элементов и относятся к алкалиметаллам. Щелочные металлы характеризуются низкой плотностью, мягкостью и низкой температурой плавления. Они обладают высокой химической активностью и реактивностью в контакте с водой и кислородом.
У щелочных металлов внешний электронный уровень имеет один электрон в своей валентной оболочке, что делает их склонными к образованию ионов с однозначным положительным зарядом. Они образуют ионы металлов с положительным зарядом, обладая ярко выраженной металлической светимостью и способностью проводить электрический ток.
Щелочные металлы широко используются в различных областях, включая производство щелочных батарей, литий-ионных аккумуляторов, сплавов, пиротехнических составов и каталитических реакций. Они также применяются в медицине, сельском хозяйстве и научных исследованиях. Благодаря своей активности и реактивности, щелочные металлы являются важными элементами в химической промышленности и находят применение во многих отраслях науки и технологий.
В заключение, щелочные металлы представляют собой группу химических элементов, обладающих высокой активностью и реактивностью. Их основные характеристики включают низкую плотность, мягкость, низкую температуру плавления и способность образовывать ионы с положительным зарядом. Щелочные металлы имеют широкое применение в различных отраслях и играют важную роль в научных и технических достижениях человечества.
Молекулярное строение щелочных металлов
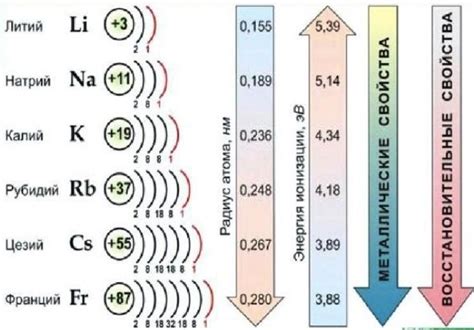
Щелочные металлы – это элементы, которые находятся в первой группе периодической таблицы. Они включают литий, натрий, калий, рубидий, цезий и франций. Широко распространены в природе и имеют разнообразные промышленные и научные применения.
Щелочные металлы обладают особым строением, которое часто называется молекулярным. Однако это название может быть немного ограничительным, так как щелочные металлы не образуют молекулы в традиционном смысле этого слова.
Строение щелочных металлов можно охарактеризовать как металлическое, где каждый атом составляет кристаллическую решетку с другими атомами. Это обусловлено тем, что щелочные металлы имеют один электрон во внешней электронной оболочке, что делает их химически активными.
В то же время, щелочные металлы имеют низкую температуру плавления и кипения, что позволяет им образовывать атомные газы при достаточно низких температурах. Однако эти атомные газы обладают особыми свойствами и не повторяют традиционное молекулярное строение.
Таким образом, хотя строение щелочных металлов можно назвать молекулярным в некотором смысле, следует помнить, что оно имеет свои особенности и отличается от молекулярного строения других химических веществ.
Щелочные металлы: примеры и свойства
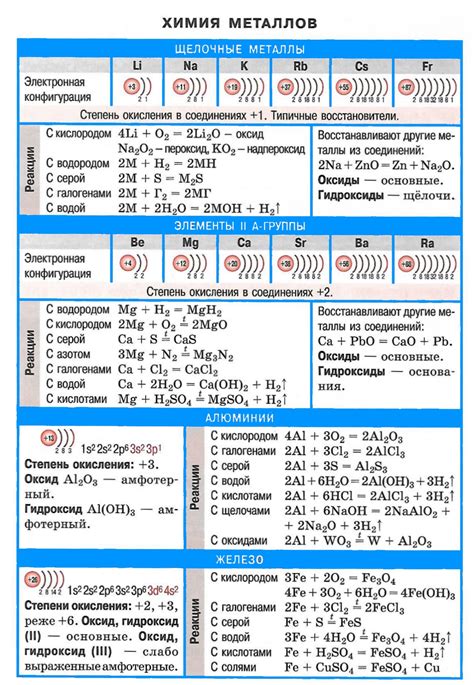
Щелочные металлы - это группа элементов, которые относятся к первой группе периодической системы, а именно: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они называются "щелочными", потому что основные оксиды, образуемые этими элементами, растворяются в воде и дают щелочные растворы.
Литий - металл серебристо-белого цвета, легкий и хрупкий. Он широко используется в производстве аккумуляторов, лекарств и сплавов. Литий имеет наименьшую плотность из всех металлов и является самым легким металлом.
Натрий - мягкий, серебристо-белый металл. Он обладает высокой электропроводностью и широко используется в производстве щелочных аккумуляторов, стекла и многих других продуктов. Натрий также играет важную роль в метаболизме организма, оказывая влияние на уровень воды и электролитного баланса.
Калий - серебристый металл, обладающий высокой реактивностью. Он широко используется в сельском хозяйстве для производства удобрений и является важным элементом растительного питания. Калий также необходим для нормального функционирования клеток и нервной системы.
Рубидий - металл серебристо-белого цвета, очень мягкий и легко расщепляющийся. Рубидий используется в электронике, оптике и ядерной энергетике. Также он применяется в медицинских исследованиях и в производстве фотоэлементов.
Цезий - металл серебристо-синего цвета, очень мягкий и низкотемпературный. Цезий применяется в газовых датчиках, а также в метрологических стандартах, измерении времени и космических исследованиях. Он также используется в радиационной терапии рака.
Франций - редкий источник радиации, а также самый реактивный щелочной металл. Из-за своей высокой реактивности и короткого периода полураспада, франций не имеет практических применений в настоящее время и исследуется только в химических исследованиях.
Щелочные металлы обладают сходными свойствами, такими как высокая электропроводность, низкая плотность и низкая температура плавления и кипения. Они также очень реактивны и легко образуют ионы положительного заряда. Чаще всего щелочные металлы находятся в состоянии соединений, таких как хлориды или оксиды.
В заключение, щелочные металлы - это группа элементов, которые имеют много применений в различных отраслях промышленности и науки. Их свойства делают их важными для нашей повседневной жизни, от производства электроники до медицины и сельского хозяйства.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это элементы первой группы периодической системы, к которым относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются низкой плотностью, низкой температурой плавления и высокой химической активностью.
Что означает, что щелочные металлы являются молекулярными?
Когда говорят, что щелочные металлы молекулярны, это означает, что они образуют молекулы, состоящие из двух атомов. Эти молекулы обладают свойствами, типичными для молекул, такими как возможность образования связей с другими молекулами и реактивность в химических реакциях.
Являются ли щелочные металлы молекулярными?
В настоящее время считается, что щелочные металлы не образуют молекулы и не являются молекулярными. Они образуют ионы, которые соединяются друг с другом, образуя кристаллическую решетку. Ионы щелочных металлов обладают химической активностью и способностью образовывать растворимые соли.
Какие свойства указывают на молекулярный характер щелочных металлов?
Ранее считалось, что свойствами, указывающими на молекулярный характер щелочных металлов, могут быть низкое плавление и кипение, низкая плотность и возможность образования соединений с молекулярными веществами. Однако современные исследования показывают, что эти свойства можно объяснить ионным характером щелочных металлов.
Почему важно знать, являются ли щелочные металлы молекулярными?
Знание о том, являются ли щелочные металлы молекулярными, имеет значение для понимания их химического поведения и свойств. Это также может быть важно для процессов их применения в различных областях науки и техники. Например, в разработке новых материалов и технологий, а также в физико-химических исследованиях.
