Металлы - одна из главных групп веществ, они имеют широкое применение в различных отраслях промышленности и техники. При этом, каждый металл обладает своей химической активностью, которая определяется его строением и электрохимическим рядом.
Строение металлов отличается от строения других веществ. Они образуют кристаллическую решетку, где атомы металла являются позитивно заряженными и образуют пространственную сеть. Эта структура обуславливает особые свойства металлов, такие как проводимость электричества и тепла, пластичность и т.д.
Кроме того, металлы расположены в электрохимическом ряду в определенном порядке. Электрохимический ряд - это упорядоченная таблица металлов по их способности отдавать или принимать электроны в реакциях окисления-восстановления. Чем выше в ряду находится металл, тем большую активность он имеет, т.е. он легче отдает электроны. А тем ниже в ряду находится металл, тем большую активность он имеет, т.е. больше электронов принимает.
Металлы: строение электрохимического ряда и химическая активность

Электрохимический ряд представляет собой упорядоченный список металлов по их способности осуществлять электрохимические реакции. Чем выше металл в ряду, тем больше его активность. В основе построения электрохимического ряда лежит принцип относительной силы окислительных и восстановительных свойств металлов. На верхней границе ряда находятся самые активные металлы, способные наиболее легко отдавать электроны и выступать в роли окислителя.
Химическая активность металлов напрямую связана с их положением в электрохимическом ряду. Активные металлы, такие как калий, натрий и литий, реагируют с водой, выделяя водород и образуя гидроксид металла. Наиболее активные металлы, такие как калий и натрий, могут даже воспламеняться при контакте с водой из-за интенсивной реакции.
Металлы, расположенные в нижней части электрохимического ряда, имеют меньшую активность и обычно не проявляют химической активности в естественных условиях. Однако они могут быть активны в специальных условиях или при повышенных температурах. Металлы, расположенные в середине ряда, такие как железо и цинк, являются умеренно активными и могут вступать в химические реакции с кислотами и водородным пероксидом.
Структура электрохимического ряда

Электрохимический ряд представляет собой упорядоченный список химических элементов, расположенный в порядке убывания их активности. Этот ряд отражает способность металлов и неметаллов участвовать в электрохимических процессах, таких как окисление и восстановление.
Структура электрохимического ряда основана на их реакционной способности. Так, наиболее активные металлы, такие как литий и калий, находятся в верхней части ряда, а наиболее пассивные, такие как золото и платина, находятся в нижней части. Неактивные газы, такие как гелий и неон, расположены в конце ряда.
Каждый элемент электрохимического ряда имеет свой потенциал окисления, который определяет его активность. Чем выше потенциал окисления элемента, тем больше его способность окислять другие вещества и выступать в качестве агента окисления. Элементы с более высокими потенциалами окисления обычно отрицательно заряжены, а элементы с более низкими потенциалами окисления обычно положительно заряжены.
Структура электрохимического ряда позволяет определить вероятность того, что реакция окисления-восстановления произойдет между двумя веществами. Если элемент находится выше в ряду, он будет способен окислить элемент, находящийся ниже него. На основании электрохимического ряда можно также предсказать направление потока электронов в гальванической или электролитической ячейке.
Влияние строения на химическую активность
Химическая активность металлов зависит от их строения и электрохимического ряда. Строение металла определяет его способность взаимодействовать с другими веществами и соединениями. Оно влияет на электрохимическую реакцию и скорость ее протекания.
Металлы, относящиеся к активным элементам электрохимического ряда, обладают высокой химической активностью. Они легко реагируют с кислородом, водой, кислотами и другими веществами. Электролитический ряд помогает определить порядок реактивности металлов и предсказать их способность вступать в химические реакции.
Строение металлов также определяет их способность образовывать ионы и электродные реакции. Ионы металлов в растворах обладают разной степенью стабильности. В химической реакции растворимости ионы меняют свое строение и связи, что влияет на химическую активность металла.
Сравнивая металлы с разным строением, можно определить, каким образом их химическая активность связана с их внутренней структурой. Например, металлы с компактной кристаллической решеткой, такие как алюминий и медь, обладают высокой механической прочностью и высокой химической активностью. В то же время, металлы с сложной кристаллической решеткой, например, титан и хром, имеют более низкую химическую активность.
Химическая активность металлов

Металлы обладают высокой химической активностью, что объясняется особенностями их строения и электронной структуры. В химических реакциях металлы готовы отдавать электроны, образуя положительно заряженные ионы – катионы. Такие реакции называются окислительно-восстановительными.
Металлы в строении электрохимического ряда расположены в порядке увеличения способности отдавать электроны. Чем выше металл в ряду, тем больше у него склонность к окислению и более высокая химическая активность. Самые активные металлы, такие как литий и калий, легко реагируют с кислородом и водой, образуя оксиды и гидроксиды.
Химическая активность металлов может быть использована в промышленности для различных целей. Например, алюминий, который является одним из самых распространенных металлов, активно применяется в производстве авиационной и автомобильной техники, а также для производства упаковочных материалов и строительных конструкций.
Химическая активность металлов также играет важную роль в биологических процессах. Многие металлы, такие как железо и магний, необходимы для правильного функционирования организма. Например, железо является неотъемлемой частью гемоглобина, который отвечает за перенос кислорода в организме. Без достаточного количества этих металлов возникают различные заболевания, связанные с нарушением обмена веществ.
Примеры реакций металлов

Металлы являются активными элементами, способными вступать в реакции с другими веществами. Одним из наиболее известных примеров реакций металлов является их взаимодействие с кислородом воздуха. Например, железо, находясь в контакте с воздухом и влагой, начинает ржаветь. Это происходит из-за окисления железа, при котором образуется окись железа(III) – ржавчина. Другим примером реакции металлов с кислородом является горение магния в воздухе при высокой температуре, которое сопровождается ярким свечением.
Кроме реакций с кислородом, металлы также могут вступать в реакции с водой. Например, натрий, находясь в контакте с водой, реагирует с ней, образуя гидроксид натрия и выделяя водород. Также, растворимые соли металлов обладают способностью реагировать с водой, образуя гидроксиды и ионы металла.
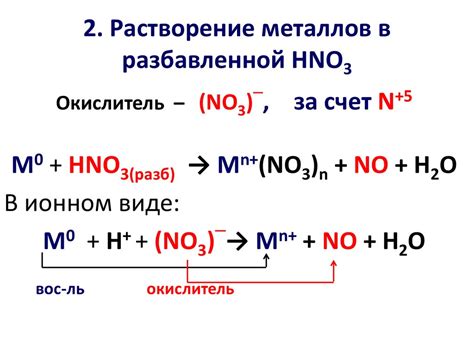
Металлы также могут вступать в реакции с кислотами. Например, цинк реагирует с соляной кислотой, выделяя водород и образуя соответствующую соль. Также, некоторые металлы, например, медь, не реагируют с обычными кислотами, но могут вступать в реакцию с сильными оксидирующими кислотами, например, азотной кислотой.
Реакции металлов могут проходить и между различными металлами. Так, например, реакция железа с медью может привести к образованию сплава - латуни.
Вопрос-ответ

Что такое электрохимический ряд?
Электрохимический ряд - это последовательность металлов, упорядоченных по их активности в реакциях с растворами ионов водорода. В данном ряду металлы располагаются в порядке убывания их электрохимической активности. Это значит, что металлы, находящиеся выше в ряду, имеют большую активность и могут вытеснить металлы, находящиеся ниже в ряду из растворов ионов их соединений.
Какой металл является самым активным по электрохимическому ряду?
Самым активным металлом по электрохимическому ряду является литий. Он располагается на самом верху ряда и обладает наибольшей способностью осуществлять окисление ионов водорода. Именно поэтому литий реагирует с водой и даже с растворяющими веществами на основе воды, такими как кислоты и щелочи.
Как связана химическая активность металлов с их положением в электрохимическом ряду?
Химическая активность металлов напрямую связана с их положением в электрохимическом ряду. Металлы, находящиеся выше в ряду, более активны и легко дают электроны во время реакций окисления. Это значит, что они имеют большую способность вступать в химические реакции и образовывать ионы. Наоборот, металлы, находящиеся ниже в ряду, менее активны и могут вытесняться активными металлами.
