Атомные связи играют ключевую роль в определении свойств металлов. Различные типы связей между атомами влияют на их структуру, прочность и электрические свойства. В основном, в металлах присутствуют металлическая связь, ионная связь и комплексные связи.
Металлическая связь - это тип связи, характерный для металлов. В металлической связи свободно движущиеся электроны образуют "море электронов", окружающее положительно заряженные металлические ионы. Это позволяет металлам быть хорошими проводниками электричества и тепла. Благодаря свободным электронам, металлы обладают высокой пластичностью и могут быть легко деформированы без ломания.
Ионные связи, с другой стороны, характерны для металлоидов и неметаллов. При ионной связи происходит обмен электронами между атомами, что приводит к образованию положительных и отрицательных ионов. Эти ионы притягиваются друг к другу электростатической силой и образуют кристаллическую решетку. Ионные связи обычно обладают высокой твердостью, но плохо проводят электричество и тепло.
Комплексные связи, наконец, возникают в результате взаимодействия металлов с другими веществами. При комплексной связи, металл образует координационные связи с лигандами, что приводит к образованию комплекса. Комплексы могут быть стабильными соединениями, обладающими специфическими свойствами, такими как каталитическая активность или способность поглощать свет. Комплексы также могут образовываться в органических соединениях, играя важную роль в биологических процессах.
Различные типы атомных связей
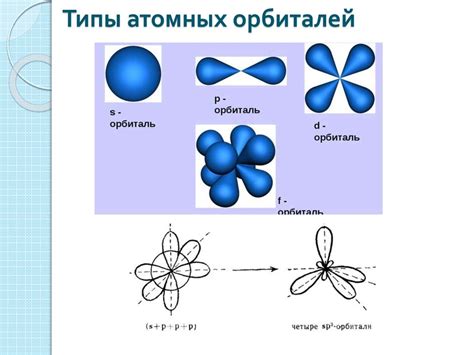
Металлы обладают различными типами атомных связей, которые определяют их свойства и особенности поведения. Основными типами связей в металлах являются металлическая связь, ионная связь и ковалентная связь. Каждый из этих типов связей обладает своими характеристиками и влияет на структуру и свойства металлов.
Металлическая связь - это тип связи, который характерен для большинства металлов. Он основан на обмене свободными электронами между атомами металла. Электроны образуют электронное облако, которое окружает положительно заряженные ионы металла. Это облако свободных электронов делает металлы проводниками электричества и тепла.
Ионная связь - это тип связи, который характерен для соединений, образованных из металлов и неметаллов. В ионной связи происходит передача электронов от одного атома к другому, образуя положительные и отрицательные ионы. Эти ионы притягиваются друг к другу электростатическими силами и образуют кристаллическую решетку. Ионная связь делает соединения твердыми и хрупкими.
Ковалентная связь - это тип связи, который характерен для соединений, образованных из неметаллов. В ковалентной связи происходит обмен электронами между атомами, при котором оба атома используют электроны общего происхождения. Этот обмен электронами позволяет атомам образовать молекулу совместно. Ковалентная связь делает соединения неметаллов непроводящими и имеющими низкую температуру плавления и кипения.
В зависимости от типа атомной связи, металлы обладают различными свойствами и могут использоваться в различных сферах применения. Металлическая связь обуславливает проводимость металлов, ионная связь делает их хрупкими и твердыми, а ковалентная связь приводит к образованию непроводящих и легко испаряющихся соединений.
Ионная связь и ее влияние на свойства металлов
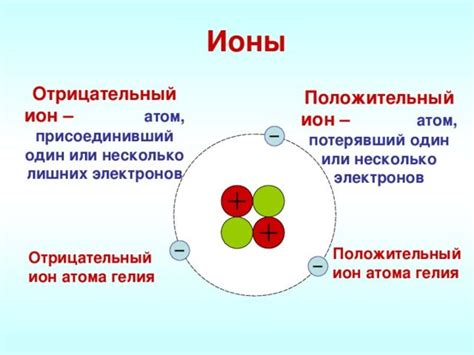
Ионная связь представляет собой тип химической связи, основанный на притяжении противоположно заряженных ионов. В металлах ионная связь играет важную роль, определяя их основные свойства.
Ионная связь в металлах образуется, когда положительно заряженные ионы металла образуют кристаллическую решетку и окружаются отрицательно заряженными ионами. Это создает силу притяжения между ионами и обеспечивает прочность и твердость металлической структуры.
Влияние ионной связи на свойства металлов проявляется в нескольких аспектах. Во-первых, ионная связь обусловливает высокую температуру плавления и кипения металлов. Ионная связь характеризуется сильной внутренней силой притяжения, которая требует большой энергии для разрушения межатомных связей.
Во-вторых, ионная связь влияет на электрическую проводимость металлов. В металлической структуре положительные ионы металла могут свободно перемещаться по кристаллической решетке, создавая электронное облако. Это позволяет металлам быть хорошими проводниками электричества.
В-третьих, ионная связь влияет на химическую реактивность металлов. Ионная связь обеспечивает устойчивость металлических ионов, что делает металлы малоактивными химическими веществами. Они обычно не реагируют с водой или кислородом воздуха, что делает их устойчивыми к коррозии и окислению.
В целом, ионная связь играет важную роль в свойствах металлов, определяя их твердость, электрическую проводимость и химическую стабильность. Понимание этого типа связи помогает в осознании поведения и свойств металлических материалов и имеет значительное значение в различных областях, включая науку и инженерию материалов.
Ковалентная связь и ее влияние на свойства металлов
Ковалентная связь — это тип химической связи, при которой два атома обменивают электроны, образуя пару электронов, которые общуются между собой. В металлах ковалентная связь играет важную роль и влияет на их свойства.
Ковалентная связь между атомами в металлах приводит к образованию кристаллической решетки. Эта решетка обладает определенной структурой, которая определяет физические и химические свойства металлов. Ковалентные связи обеспечивают прочность металлов, благодаря чему они обладают высокой пластичностью и прочностью.
Кроме того, ковалентная связь в металлах определяет электронную проводимость. В металлах электроны свободно передвигаются по решетке, что позволяет металлам быть отличными проводниками электричества. Благодаря этому свойству металлы широко используются в электротехнике и электронике.
Ковалентная связь также влияет на температуру плавления и кипения металлов. При нагревании энергия воздействует на ковалентные связи, приводя к их разрыву и переходу в жидкое состояние. При этом, благодаря особенностям ковалентной связи, металлы обладают высокими температурами плавления и кипения.
Таким образом, ковалентная связь играет важную роль в определении свойств металлов. Она обеспечивает прочность, электронную проводимость, а также высокую температуру плавления и кипения. Эти свойства делают металлы незаменимыми материалами в различных отраслях промышленности и науки.
Металлическая связь и ее влияние на свойства металлов

Металлическая связь является одним из главных типов атомных связей в металлах и оказывает существенное влияние на их физические и химические свойства. Она образуется между ионами металла и свободными электронами, которые могут свободно двигаться в объеме кристаллической решетки металла.
Электроны, участвующие в металлической связи, образуют так называемое «электронное облако», которое эффективно связывает положительно заряженные ионы металла. Это обуславливает такие свойства металлов, как высокая пластичность, хорошая электропроводность и теплопроводность.
Именно благодаря свободному движению электронов, металлы обладают высокой электропроводностью. Они легко переносят электрический ток, что делает их незаменимыми материалами для проводников в различных электронных устройствах. Кроме того, электроны, связанные с ионами металла, могут легко переходить на соседние ионы под действием электрического поля, что обеспечивает возможность деформации металла, его пластичность и формовку.
Металлическая связь также отвечает за высокую теплопроводность металлов. Электроны, перемещаясь в металлической решетке, переносят тепловую энергию от области с более высокой температурой к области с более низкой температурой. Благодаря этому свойству металлы широко используются в теплообменных системах и производстве различных теплоизоляционных материалов.
Таким образом, металлическая связь является ключевым фактором, определяющим уникальные физические и химические свойства металлов. Она обеспечивает металлам высокую пластичность, электропроводность и теплопроводность, что делает их ценными материалами в различных сферах промышленности и технологий.
Водородная связь и ее влияние на свойства металлов
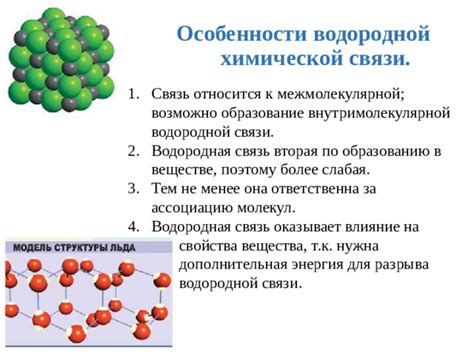
Водородная связь является особой формой слабой химической связи, которая играет важную роль во многих физических и химических свойствах металлов.
Внутри металлической решетки атомы металла удерживаются вместе с помощью металлической связи, которая осуществляется за счет обмена электронами между атомами. Однако в случае, когда атомы металла вступают во взаимодействие с атомами водорода, происходит образование водородной связи.
Водородная связь между атомами водорода и металлами является слабой и недолговечной, однако она может оказывать значительное влияние на свойства металлов. Водородная связь может снижать температуру плавления металлов, увеличивать их твердость и прочность, а также изменять их электропроводность.
Также водородная связь может влиять на магнитные свойства металлов. Некоторые металлы, например железо, могут образовывать специфические структуры с атомами водорода, что приводит к изменению их магнитных свойств. Это может быть полезно в различных технологических приложениях, таких как производство магнитных материалов.
Таким образом, водородная связь имеет значительное влияние на свойства металлов и может быть использована для улучшения их физических и химических характеристик. Это делает водородную связь одним из важных аспектов в изучении и применении металлов.
Вопрос-ответ

Какие типы атомных связей существуют в металлах?
В металлах существуют два основных типа атомных связей — металлическая связь и сван-связь. Металлическая связь проявляется в обмене электронами между атомами металла, образуя так называемое "электронное облако". Сван-связь, или диамантовый тип связи, характерен для некоторых двухатомных молекул, в которых происходит обмен электронами между атомами, образуя ковалентную связь.
Как металлическая связь влияет на свойства металлов?
Металлическая связь обуславливает множество характерных свойств металлов. Благодаря свободному движению электронов, металлы обладают высокой электропроводностью и теплопроводностью. Они также обладают способностью образовывать частично или полностью ионные соединения с неметаллами, что позволяет им активно взаимодействовать с другими веществами и обладать высокой химической активностью.
