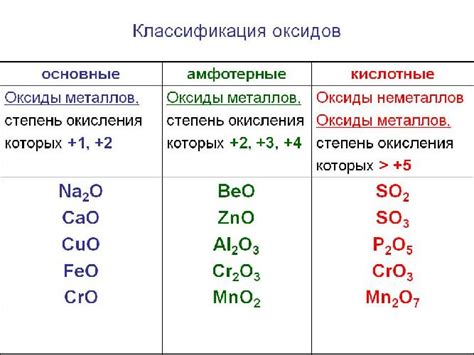
Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. Они являются одними из основных компонентов неорганической химии и широко используются в различных областях науки и техники. Кроме того, оксиды металлов имеют важное значение для понимания реакций, происходящих в природе и в промышленности.
Уравнение диссоциации оксидов металлов – это химическое уравнение, описывающее процесс, при котором оксид металла распадается на ионы металла и ионы кислорода в растворе или при нагревании. Такой процесс может происходить как водным растворе, так и в газовой фазе.
Например, уравнение диссоциации оксида железа:Fe2O3 → 2Fe3+ + 3O2-
В данном случае оксид железа Fe2O3 разлагается на два иона трехвалентного железа Fe3+ и три иона кислорода O2-. Данное уравнение показывает, что при диссоциации оксида железа образуются ионы металла и ионы кислорода, которые могут участвовать в дальнейших химических реакциях.
Оксиды металлов: суть и свойства
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Эти соединения широко распространены в природе и обладают рядом особых свойств и химических реакций.
Важным свойством оксидов металлов является их способность диссоциировать в водных растворах. При контакте с водой оксиды металлов образуют гидроксиды, что связано с высокой активностью кислорода в таких соединениях.
Диссоциация оксидов металлов играет важную роль в химических процессах. Она позволяет металлам вступать в реакции с различными соединениями и обеспечивает металлоокиснительные и восстановительные свойства этих веществ.
Оксиды металлов обладают различными физическими и химическими свойствами. Например, некоторые оксиды являются кислотными, другие - щелочными, третьи не обладают определенной кислотно-щелочной реакцией. Некоторые оксиды металлов обладают электропроводностью, что позволяет им использоваться в электротехнике и электрохимии.
Оксиды металлов важны и с практической точки зрения. Например, они используются в производстве стали, керамики, стекла и других материалов. Кроме того, некоторые оксиды металлов обладают антисептическими свойствами и используются в медицине для лечения инфекций и ран.
Уравнение диссоциации оксидов: общая формула и принципы

Диссоциация оксидов металлов возникает при их растворении в воде или при нагреве. Уравнение диссоциации оксидов описывает процесс разложения оксида на ионы металла и кислорода. Общая формула таких уравнений выглядит следующим образом:
МxOy → xMz+ + yO2-
В данной формуле М обозначает металл, а О - кислород. x и y - это числа, обозначающие соответственно количество ионов металла и ионов кислорода, которые образуются при диссоциации оксида.
Уравнение диссоциации оксида металла может быть балансировано, чтобы количество ионов металла и ионов кислорода совпадало с составом оксида. Например, для оксида алюминия Al2O3 уравнение диссоциации будет выглядеть следующим образом:
Al2O3 → 2Al3+ + 3O2-
Принципы уравнения диссоциации оксидов заключаются в том, чтобы уравнять количество ионов металла и ионов кислорода с помощью коэффициентов перед формулами соответствующих ионов. Также важно учесть заряд ионов металла и ионов кислорода, чтобы обеспечить электрическую нейтральность соединения. В результате балансировки уравнения можно получить информацию о количестве ионов металла и ионов кислорода, образующихся при диссоциации оксида металла.
Балансировка уравнения диссоциации оксида металла является важным шагом для понимания свойств оксидов и их реакций с другими веществами. Это позволяет установить степень окисления металла и его активность в химических реакциях.
Примеры уравнения диссоциации оксидов металлов

Оксиды металлов могут диссоциировать в водных растворах и образовывать металлические катионы и оксидные ионы. Вот несколько примеров уравнений диссоциации оксидов металлов:
1. Диссоциация оксида натрия:
- Na2O → 2Na+ + O2-
2. Диссоциация оксида магния:
- MgO → Mg2+ + O2-
3. Диссоциация оксида кальция:
- CaO → Ca2+ + O2-
4. Диссоциация оксида железа(III):
- Fe2O3 → 2Fe3+ + 3O2-
5. Диссоциация оксида алюминия:
- Al2O3 → 2Al3+ + 3O2-
Это лишь некоторые примеры уравнений диссоциации оксидов металлов. В зависимости от конкретного оксида металла, уравнение может быть различным, но принцип диссоциации будет одинаковым: оксид разделяется на ионы металла и оксидные ионы. Понимание этих принципов может быть полезным для объяснения химических реакций и свойств оксидов металлов.
Значение уравнения диссоциации оксидов в промышленности и научных исследованиях
Уравнение диссоциации оксидов металлов играет важную роль как в промышленности, так и в научных исследованиях, благодаря своей способности показывать взаимодействие оксидов с водой и другими веществами. Это уравнение помогает определить, какие продукты образуются в результате диссоциации оксидов и насколько эти продукты реакции являются стабильными.
В промышленности знание уравнения диссоциации оксидов металлов позволяет оптимизировать процессы производства и повысить эффективность применяемых веществ. Например, уравнение диссоциации оксида железа помогает оценить, сколько кислорода понадобится для получения определенного количества металла. С помощью данного уравнения можно также предсказать, какие взаимодействия оксида железа будут происходить с другими веществами и какие на это необходимы условия.
В научных исследованиях уравнение диссоциации оксидов металлов позволяет изучать их химические свойства и взаимодействие с различными соединениями. Зная данное уравнение, исследователи могут определить, какие реакции могут происходить с оксидами металлов и какие вещества образуются в результате этих реакций. Это помогает разрабатывать новые материалы с определенными свойствами и применением.
Все эти факторы подчеркивают значимость уравнения диссоциации оксидов металлов и его применение в различных областях. Уравнение дает возможность прогнозировать результаты химических реакций и изучать свойства веществ, что открывает перспективы для применения в промышленности и научных исследованиях.
Вопрос-ответ

Какие принципы лежат в основе уравнения диссоциации оксидов металлов?
Основным принципом уравнения диссоциации оксидов металлов является расщепление молекул оксида на ионы, где положительно заряженный ион соответствует металлу, а отрицательно заряженный ион – кислороду. В результате такой диссоциации металлический оксид превращается в растворимую в воде соль металла.
Какие примеры можно привести для уравнения диссоциации оксидов металлов?
Примеры уравнений диссоциации оксидов металлов включают такие реакции, как диссоциация оксида кальция (CaO): CaO → Ca2+ + O2-, или диссоциация оксида меди (CuO): CuO → Cu2+ + O2-. В обоих случаях образуется положительно заряженный ион металла и отрицательно заряженный ион кислорода.
Для чего нужно уравнение диссоциации оксидов металлов?
Уравнение диссоциации оксидов металлов позволяет описать процесс расщепления молекул оксидов и образования ионов, что является важным при изучении химических реакций и свойств соединений. Также оно позволяет представить оксид металла в виде растворимой соли металла, что может быть полезно в различных химических процессах и промышленности.
Какие еще принципы можно использовать при уравнении диссоциации оксидов металлов?
Помимо основного принципа расщепления молекул оксида на ионы, можно использовать дополнительные принципы в зависимости от реакции и конкретного оксида металла. Например, для оксида металла с переменной степенью окисления, можно использовать принцип о сохранении общего заряда, чтобы определить степень окисления металла и состав уравнения диссоциации.
