Щелочноземельные металлы - это группа химических элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они расположены во второй группе периодической системы элементов и обладают рядом общих химических свойств.
Одним из основных свойств щелочноземельных металлов является их высокая реактивность, особенно при взаимодействии с кислородом. Бериллий, магний и кальций быстро окисляются на воздухе, образуя оксиды, которые имеют ярко выраженные щелочные свойства. Соединения этих металлов обладают высокой теплостойкостью и могут использоваться в различных промышленных процессах.
Важным свойством щелочноземельных металлов является их способность образовывать соединения с другими элементами, включая кислород, серу, фосфор и азот. Так, магний может образовывать хлориды, сульфаты и фосфаты, которые находят широкое применение в сельском хозяйстве, строительной отрасли и медицине.
Важно: Соединения щелочноземельных металлов имеют различные цвета и свойства. Например, соединения бериллия обладают высокой токсичностью, в то время как барий используется в производстве стекла и пигментов.
Щелочноземельные металлы также характеризуются высокой электропроводностью и применяются в производстве сплавов, магниевых литейных материалов и аккумуляторов. Они также находят применение в процессах осаждения металлических покрытий, при производстве огнеупорных материалов и при очистке воды.
В заключение, щелочноземельные металлы обладают множеством важных свойств и широким спектром применения в различных отраслях промышленности и науки. Изучение соединений и основных свойств этих элементов позволяет расширить наше понимание химии и разработать новые технологии и материалы.
Свойства щелочноземельных металлов

Щелочноземельные металлы – это группа химических элементов, которые находятся во второй группе периодической таблицы. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У щелочноземельных металлов есть несколько общих свойств, которые делают их уникальными.
- Высокая реактивность: Щелочноземельные металлы очень активны химически и быстро реагируют с другими веществами. Они имеют большую склонность к образованию ионов положительного заряда, что делает их хорошими источниками электрической энергии.
- Низкая плотность: Щелочноземельные металлы имеют низкую плотность, что означает, что они легкие и хорошо плавают в воде. Это делает их полезными для использования в авиации и судостроении.
- Высокая теплопроводность: Щелочноземельные металлы обладают высокой теплопроводностью, что означает, что они могут передавать тепло с большой эффективностью. Это делает их полезными для использования в области радиаторов и систем охлаждения.
- Низкая электропроводность: Щелочноземельные металлы имеют низкую электропроводность, что означает, что они плохо проводят электрический ток. Однако, они могут быть легко ионизированы, что позволяет использовать их в большом количестве электронных приборов.
Щелочноземельные металлы имеют широкий спектр применений в различных областях науки и промышленности. Они используются в производстве легких сплавов, в составе батарей, в производстве стекла и керамики, а также в медицине и агрокультуре. Их свойства делают их ценными источниками материалов и веществ, которые широко применяются в современной технологии и промышленности.
Соединения щелочноземельных металлов
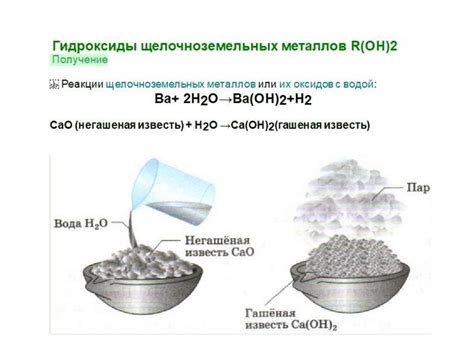
Щелочноземельные металлы – это группа элементов, расположенная во 2 группе периодической системы. Они образуют различные соединения с другими химическими элементами.
Одним из наиболее распространенных соединений щелочноземельных металлов являются их оксиды. Например, оксид кальция (CaO), известный также как негашеная известь, широко применяется в строительной и химической промышленностях. Оксиды щелочноземельных металлов обладают щелочными свойствами и могут использоваться в процессах нейтрализации кислых соединений.
Другой важной группой соединений щелочноземельных металлов являются их гидроксиды. Например, гидроксид бария (Ba(OH)2) используется в производстве стекла, в качестве катализатора и в лечебных целях. Гидроксиды щелочноземельных металлов обладают щелочными свойствами и способны образовывать растворы щелочной реакции.
Щелочноземельные металлы также способны образовывать соединения с галогенами. Например, хлорид кальция (CaCl2) используется для сушки воздуха, в процессе обеспечения безопасности на дорогах зимой и в качестве добавки в пищевой промышленности. Галогениды щелочноземельных металлов обладают высокой растворимостью в воде и широко используются в химической и фармацевтической промышленностях.
Также щелочноземельные металлы образуют соединения с кислородсодержащими кислотами, например, сульфатами и нитратами. Например, сульфат магния (MgSO4) применяется в медицине и сельском хозяйстве, а нитрат кальция (Ca(NO3)2) используется в производстве керамики и селитры.
Степень окисления щелочноземельных металлов

Щелочноземельные металлы имеют характерные степени окисления, которые определяют их химические свойства. В основном, щелочноземельные металлы проявляют степени окисления +2. Это означает, что они готовы отдать два электрона для образования ионов с двояким положительным зарядом.
Тем не менее, некоторые щелочноземельные металлы, такие как бериллий и магний, способны проявлять и степень окисления +1. Эта возможность связана с их электронной конфигурацией и наличием непарных электронов в валентной оболочке. В результате, бериллий и магний могут образовывать соединения с одноименными ионами +1 заряда.
Стоит также отметить, что степень окисления щелочноземельных металлов может изменяться в некоторых комплексных соединениях. Например, Магний может проявлять и степень окисления +2, и степень окисления +1 в зависимости от среды и условий.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы – это группа элементов, которая включает в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У данных металлов есть несколько общих химических свойств.
Первое общее свойство щелочноземельных металлов – это то, что они образуют двухвалентные ионы, т.е. ионы с двумя положительными зарядами (+2). Это связано с тем, что у этих элементов на внешнем энергетическом уровне находятся два электрона. Соединения щелочноземельных металлов, как правило, обладают свойствами ионных соединений, в которых положительно заряженные ионы металла образуют кристаллическую решетку с отрицательно заряженными анионами.
Второе общее свойство щелочноземельных металлов – это их реактивность. Они являются активными металлами и легко реагируют с водой, кислородом и кислотами. Например, реакция кальция с водой приводит к образованию оксида кальция и выделению водорода:
Ca + 2H2O → Ca(OH)2 + H2
Третье общее свойство щелочноземельных металлов – это способность образовывать сольные соединения. Металлы этой группы образуют соли с различными кислотами, например, хлориды, нитраты, сульфаты и др. Соли щелочноземельных металлов обладают ярко-выраженной ионной связью и кристаллической структурой.
Щелочноземельные металлы – это важные элементы как в химии, так и в технике. Они широко используются в производстве различных сплавов, стекла, а также в лабораторной практике.
Физические свойства щелочноземельных металлов

Плотность: Щелочноземельные металлы имеют низкую плотность. Например, плотность магния составляет примерно 1,74 г/см³, что делает его легким веществом.
Точка плавления: Щелочноземельные металлы обладают низкой точкой плавления. Например, точка плавления кальция составляет около 842°C.
Тепло и электропроводность: Щелочноземельные металлы хорошие проводники тепла и электричества. Они обладают высокими значениями теплопроводности и электропроводности.
Мягкость: Щелочноземельные металлы являются относительно мягкими и податливыми. Например, магний можно резать ножом.
Относительная атомная масса: Атомные массы щелочноземельных металлов увеличиваются вдоль периодической таблицы. Например, начиная с бериллия и заканчивая барием, относительные атомные массы металлов увеличиваются по мере увеличения заряда ядра атома.
Реакция с водой: Щелочноземельные металлы реагируют с водой, в результате чего выделяется водород. Однако, реактивность металлов увеличивается по мере увеличения их атомной массы.
Применение щелочноземельных металлов

Щелочноземельные металлы, такие как магний, кальций и стронций, имеют широкое применение в различных областях науки и техники. Они отличаются высокой электропроводностью, низкой плотностью и химической активностью.
Одним из главных применений щелочноземельных металлов является использование их сплавов в промышленности. Например, сплавы магния с другими металлами широко используются в авиационной и автомобильной отраслях. Эти сплавы отличаются низким весом и высокой прочностью, что делает их идеальными для создания легких и прочных конструкций.
Кроме того, кальций и стронций применяются в производстве различных соединений и материалов. Например, оксид кальция используется в производстве цемента, гидроксид кальция – в производстве щелочей и керамических материалов, а нитрат стронция – в производстве пиротехнических композиций и светоизлучающих диодов.
Другим важным применением щелочноземельных металлов является их роль в биологии. Кальций, магний и стронций являются необходимыми микроэлементами для живых организмов и играют важную роль в обмене веществ, функционировании нервной системы и строительстве костей и зубов.
Вопрос-ответ

Что такое щелочноземельные металлы?
Щелочноземельные металлы - это химический класс элементов, включающий в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они относятся к группе 2 периодической системы элементов и характеризуются общими свойствами, такими как низкая электроотрицательность, активная реакционность с кислородом и образование щелочноземельных оксидов и гидроксидов.
В каких соединениях применяют щелочноземельные металлы?
Щелочноземельные металлы используются в различных соединениях и промышленных процессах. Например, бериллий широко применяется в производстве сплавов, а магний используется в производстве легких сплавов и антикоррозионных материалов. Кальций используется в производстве стекла и цемента, а барий - в производстве радиоактивных и красящих веществ. Строний и радий имеют ограниченное применение из-за их высокой токсичности.
Какие основные свойства характеризуют щелочноземельные металлы?
Основные свойства щелочноземельных металлов включают низкую электроотрицательность, высокую термо- и химическую реакционность, активное образование соединений с кислородом и образование белых соединений с кислотами, известные как щелочноземельные соли. Они также хорошо проводят тепло и электричество, имеют низкие плотности и низкие температуры плавления и кипения.
Какие опасности могут представлять щелочноземельные металлы?
Щелочноземельные металлы могут представлять опасность при неправильном обращении с ними. Например, бериллий и строний являются токсичными и могут вызывать серьезные заболевания, если попадут в организм. Кроме того, некоторые щелочноземельные металлы, например, магний и барий, очень реактивны и могут зажигаться при контакте с водой или воздухом. Поэтому необходимо соблюдать меры предосторожности при работе с этими веществами.
