Электролиз – это электрохимический процесс, при котором под воздействием электрического тока происходит разложение вещества на ионы. Один из основных параметров этого процесса - масса металла, которая осаждается на катоде. Расчет этой массы требует знания массы заряда, молярной массы металла и числа переносимых электродами Кулонов.
Для расчета массы металла на катоде необходимо знать количество переданных электродами Кулонов за время электролиза. Количество электричества измеряется в кулонах (С), а время электролиза – в секундах (с). Зная это значение, можно расчитать количество вещества, прошедшее через электролит, с помощью формулы Q = I * t, где Q - заряд, I - сила электрического тока, а t - время электролиза.
Далее, зная количество вещества (выраженное в молях), можно расчитать массу металла, осажденного на катоде, с помощью молярной массы металла. Молярная масса - это масса одного моля вещества, выраженная в граммах. Таким образом, масса металла, осажденного на катоде, равна произведению молярной массы металла на количество вещества.
Расчет массы металла

Расчет массы металла, получаемого на катоде при проведении электролиза, может быть осуществлен с использованием закона Фарадея. Закон Фарадея утверждает, что масса металла, образующегося на катоде, пропорциональна количеству электричества, протекающего через электролит.
Для расчета массы металла на катоде используется формула: m = Q × M / (n × F), где m - масса металла, Q - количество электричества, M - молярная масса металла, n - количество электронов, вступивших в реакцию восстановления, F - постоянная Фарадея.
Количество электричества (Q) рассчитывается по формуле: Q = I × t, где I - сила тока, протекающего через электролит, t - время, в течение которого происходит электролиз.
Молекулярная масса металла (M) находится в таблице химических элементов. Количество электронов (n), вступающих в реакцию восстановления, определяется по химическому составу соединения металла.
Полученная при расчете масса металла (m) является теоретической и может незначительно отличаться от фактически полученной массы металла вследствие потерь в процессе электролиза.
Понятие и принципы электролиза
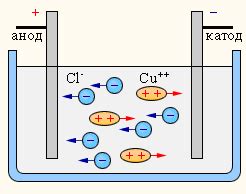
Электролиз - это процесс разложения вещества под действием электрического тока. Используется для получения металлов, химических элементов и соединений, а также для очистки и обработки различных материалов.
Основой электролиза являются два электрода: катод и анод, погруженные в электролит. Катод - это отрицательно заряженный электрод, на котором происходит восстановление положительных ионов электролита. Анод - положительно заряженный электрод, на котором происходит окисление отрицательных ионов электролита. Процесс электролиза происходит только при подаче электрического тока.
Принцип работы электролиза основан на притяжении и отталкивании заряженных частиц электролита электродами. Положительные заряды (катионы) движутся к катоду, где они получают электроны и осаждаются в виде вещества. Отрицательные заряды (анионы) движутся к аноду, где они отдают электроны и участвуют в окислительных реакциях. Таким образом, на катоде образуется металл или соединение, а на аноде происходит окисление вещества.
Расчет массы металла на катоде при проведении электролиза основан на законах электролиза. Масса вещества, которое осаждается на катоде, пропорциональна количеству заряда, прошедшего через электролит. Данный закон формулируется как: масса вещества равна произведению его эквивалентной массы на количество протекших кулонов. Эквивалентная масса определяется отношением массы вещества к числу ионов в молекуле или ионе.
Таким образом, использование электролиза позволяет получать металлы и соединения с высокой чистотой, а также проводить различные химические преобразования и очистку материалов. Расчет массы осажденного вещества является важной составляющей данного процесса и основан на законах электролиза.
Катод и его роль в процессе электролиза
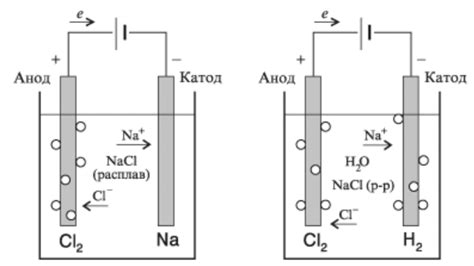
Катод является одним из важных элементов в процессе электролиза. Он представляет собой отрицательный электрод, к которому притягиваются положительно заряженные ионы в растворе или электролите.
Задача катода в процессе электролиза заключается в превращении положительно заряженных ионов в нейтральные атомы или молекулы. Для этого катод должен иметь покрытие из подходящего материала, такого как металл или углерод. Он также должен обладать определенными физическими и электрохимическими свойствами, чтобы обеспечить эффективность процесса и достичь желаемого результата.
Катод выполняет функцию собирателя электронов, которые передаются ему через внешнюю цепь от источника электрической энергии. Электроны, поступая на катод, переносят энергию, необходимую для проведения реакции восстановления положительно заряженных ионов. Как результат, на катоде образуются нейтральные атомы или молекулы вещества, присутствующего в растворе или электролите.
Количество нейтральных атомов или молекул, образующихся на катоде, зависит от величины тока, времени электролиза и стехиометрических соотношений в реакции восстановления. Это позволяет расчитать массу металла, образующегося на катоде в процессе электролиза, с использованием соответствующих физических и химических закономерностей.
Методика расчета массы металла на катоде

Расчет массы металла на катоде при проведении электролиза является важным этапом при изучении и исследовании химических процессов. Данный метод позволяет определить количество выделяемого металла и оценить эффективность проведенного электролиза.
Для начала расчета необходимо знать силу тока и время электролиза. Из физических законов следует, что масса металла, выделяемого на катоде, прямо пропорциональна продукту силы тока и времени. Таким образом, чем больше сила тока и времени электролиза, тем больше будет выделяться металла.
Однако, помимо силы тока и времени, необходимо также учитывать заряд каждого иона металла. Для этого используются данные таблицы стандартных потенциалов (электродных потенциалов), где указываются значения стандартного электродного потенциала для различных веществ. Заряд ионов металла можно получить, используя эту таблицу и указанные в ней значения.
Итак, для расчета массы металла на катоде необходимо умножить произведение силы тока и времени электролиза на заряд каждого иона металла, и получившееся значение разделить на число Фарадея. Таким образом, мы получим массу металла, которая будет выделяться на катоде при проведении электролиза.
Важно отметить, что данная методика расчета является приближенной и может существенно отличаться от фактических результатов. В реальных условиях электролиза могут происходить различные побочные реакции, а также возможны потери металла при снятии отложений с электрода. Поэтому результаты расчета необходимо рассматривать с осторожностью и проводить дополнительные эксперименты для подтверждения полученных данных.
Пример расчета массы металла на катоде при проведении электролиза

При проведении электролиза в растворе металлической соли масса металла, выделяющегося на катоде, может быть рассчитана по формуле:
металл на катоде = заряд электролиза / заряд носителей заряда * молярная масса металла
Для расчета массы металла на катоде необходимо знать заряд электролиза, который можно вычислить по формуле:
заряд электролиза = напряжение между электродами * ток электролиза * время электролиза
Также для расчета массы металла необходимо знать заряд носителей заряда, который можно вычислить по формуле:
заряд носителей заряда = число моль электролита * Авогадро число * заряд иона
Используя полученные значения, можно рассчитать массу металла на катоде и определить его количество в процессе электролиза.
Пример расчета массы металла на катоде можно привести на примере электролиза раствора медного купороса (CuSO4). Пусть проведение электролиза занимает 5 минут (300 секунд), напряжение между электродами составляет 12 Вольт, а ток электролиза 1 Ампер. Молярная масса меди (Cu) равна 63,55 г/моль, а заряд иона Cu2+ равен 2 (заряд протона).
Сначала необходимо рассчитать заряд электролиза:
заряд электролиза = 12 * 1 * 300 = 3600 Кулон
Затем вычисляем заряд носителей заряда:
заряд носителей заряда = 1 * 6,022 * 10^23 * 2 = 1,2044 * 10^24 Кулон
Далее рассчитываем массу металла на катоде:
металл на катоде = 3600 / 1,2044 * 10^24 * 63,55 = 1,77 * 10^-20 г
Таким образом, при проведении электролиза раствора медного купороса масса выделяющегося металла на катоде составит примерно 1,77 * 10^-20 г.
Вопрос-ответ

Как рассчитать массу металла на катоде при проведении электролиза?
Для расчета массы металла на катоде при электролизе используется формула, известная как закон Фарадея. Согласно закону Фарадея, количество металла, выделившегося на катоде, пропорционально количеству электричества, прошедшему через раствор, и коэффициенту электрохимической эквивалентности металла. Формула для расчета массы металла на катоде выглядит следующим образом: m = Q * M / (n * F), где m - масса металла, Q - количество электричества, M - молярная масса металла, n - число электронов, необходимых для восстановления одной молекулы металла, F - постоянная Фарадея. Расчет проводится путем подстановки известных значений в данную формулу.
Какая формула используется для расчета массы металла на катоде при электролизе?
Для расчета массы металла на катоде при проведении электролиза используется формула m = Q * M / (n * F), где m - масса металла, Q - количество электричества, прошедшего через раствор, M - молярная масса металла, n - число электронов, необходимых для восстановления одной молекулы металла, F - постоянная Фарадея. Эта формула основана на законе Фарадея, который устанавливает пропорциональность между количеством металла, выделившегося на катоде, и количеством электричества, прошедшего через раствор.
