Бромоводородная кислота (HBr) является одной из самых распространенных и важных кислот в химии. Она обладает значительным влиянием на реакцию между металлами и другими соединениями. Взаимодействие бромоводородной кислоты с металлами может провоцировать различные реакции, которые могут быть как полезными, так и опасными.
Особенностью реакции между бромоводородной кислотой и металлами является выделение водорода. При этом образуется бромид металла. В зависимости от металла и условий реакции, продуктами реакции могут быть как растворимые соли, так и нерастворимые соединения.
Некоторые металлы, такие как цинк (Zn), алюминий (Al) и железо (Fe), реагируют с бромоводородной кислотой достаточно интенсивно, выделяя значительное количество водорода и образуя растворимые бромиды. Другие металлы, например медь (Cu) и серебро (Ag), образуют нерастворимые бромиды, что является основой для некоторых химических тестов.
В общем, взаимодействие бромоводородной кислоты с металлами имеет широкий спектр применений и может быть полезным как в химических лабораториях, так и в промышленности. Однако следует помнить об опасности работы с кислотой и соблюдать все необходимые меры предосторожности.
Определение бромоводородной кислоты
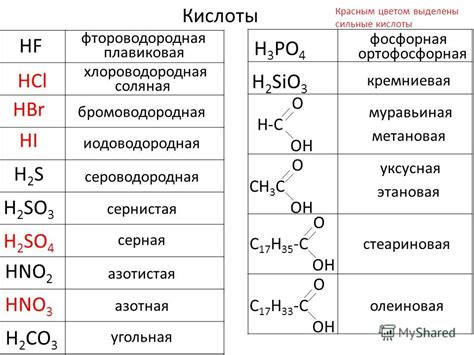
Бромоводородная кислота (HBr) – бесцветная газообразная химическая соединение, обладающая резким запахом. Её молекула состоит из атомов водорода (H) и брома (Br), соединённых между собой ковалентными связями.
Для определения бромоводородной кислоты можно провести несколько лабораторных экспериментов. Один из них основан на реакции HBr с аммиаком (NH3). При взаимодействии этих веществ образуется белое твёрдое соединение – хлорид аммония (NH4Br). Эта реакция можно использовать для качественного анализа наличия бромоводородной кислоты в растворе.
Также можно определить присутствие HBr с помощью индикаторов, которые меняют окраску при различных значениях рН. Например, метилоранж (при доступности кислорода окрашивает в желто-оранжевый цвет) или фенолфталеин (в щелочной среде приобретает розовый цвет).
Для более точного определения концентрации бромоводородной кислоты применяют титрование – метод, основанный на точном дозировании раствора известной концентрации реагента (титранта) до появления первого признака окончания химической реакции. Популярным титрантом для определения HBr является гидроксид натрия (NaOH).
Основные составляющие

Бромоводородная кислота (HBr) - это бинарная кислота, состоящая из водорода (H) и брома (Br). Кислота обладает характерным запахом и высокой коррозионной активностью. Она легко растворяется в воде, образуя раствор сильной кислотности.
Металлы - это элементы, которые обладают благоприятными физическими и химическими свойствами. Они могут проводить тепло и электричество, имеют высокую пластичность и прочность. Металлы обычно образуют катионы, отдавая свои валентные электроны в реакциях.
Взаимодействие металлов с бромоводородной кислотой - это процесс, в результате которого образуются соли металлов и бромиды. Бромоводородная кислота вступает в реакцию с металлами, вытесняя водород и образуя соответствующие соли. Реакция может протекать с различной интенсивностью, в зависимости от химических свойств металла.
Оксиды металлов - это неорганические соединения, состоящие из металла и кислорода. Эти соединения могут протекать реакцию с бромоводородной кислотой, образуя соответствующие бромиды и воду. Реакция оксидов металлов с бромоводородной кислотой может обладать как кислотно-основными, так и окислительно-восстановительными свойствами.
Свойства бромоводородной кислоты
Бромоводородная кислота – это бесцветный газ с резким запахом и резким жгучим вкусом. Он хорошо растворяется в воде, образуя кислый раствор.
Газовая бромоводородная кислота является агрессивным веществом. Она обладает сильными кислотными свойствами. Ее раствор является сильным окислителем и коррозионным агентом.
Бромоводородная кислота проявляет схожие с хлороводородной кислотой свойства. Она является аналогом хлороводородной кислоты, в которой атомы водорода заменены на атомы брома.
Бромоводородная кислота образует соли – бромиды, при взаимодействии с металлами. Она реагирует с щелочами, образуя бромид и воду. Бромоводородная кислота проявляет аналогичное поведение при взаимодействии с основаниями.
Как и другие кислоты, бромоводородная кислота образует двойные соли, например, аммия гидробромид.
Бромоводородная кислота также может вызывать серьезные ожоги кожи и слизистых оболочек при контакте. Поэтому при работе с этим веществом необходимо соблюдать осторожность и использовать защитное снаряжение.
Реакция бромоводородной кислоты с металлами

Бромоводородная кислота (HBr) обладает выраженными кислотными свойствами и может взаимодействовать с металлами. Однако реакционная способность HBr с металлами может существенно различаться в зависимости от свойств металла и условий реакции.
Металлы различаются по степени активности, и это сильно влияет на скорость и интенсивность реакции с HBr. Например, активные металлы, такие как натрий, калий и магний, реагируют быстро и интенсивно с HBr, образуя бромиды металла и выделяя водород.
Реакция металлов с HBr обычно сопровождается выделением газа водорода, что делает ее легко обнаружимой. Например, реакция натрия с HBr приводит к образованию бромида натрия и выделению водорода:
2 Na + 2 HBr = 2 NaBr + H2↑
Некоторые металлы, такие как алюминий и цинк, могут реагировать с HBr только при наличии воды, поскольку водород выделяется только в присутствии влаги:
2 Al + 6 HBr + 3 H2O = 2 Al(Br)3 + 6 H2↑
В реакции с HBr также могут образовываться гидрогенбромиды металла, координационные водородные соединения, которые обычно существуют в виде кристаллических соединений с высоким плавлением и кипением.
- Бромоводородная кислота реагирует с металлами, образуя бромиды металла.
- Активные металлы реагируют быстро и интенсивно, выделяя водород.
- Некоторые металлы требуют наличия воды для реакции с HBr.
- Возможно образование гидрогенбромидов металла.
Бромоводородная кислота и ее влияние на металлы

Бромоводородная кислота - химическое соединение, состоящее из брома и водорода, которое может проявлять активность при взаимодействии с металлами. Взаимодействие бромоводородной кислоты с металлическими элементами может привести к различным химическим реакциям.
Одной из особенностей взаимодействия бромоводородной кислоты с металлами является возможность образования соответствующих солей. В зависимости от условий и конкретных факторов, таких как концентрация кислоты и площадь поверхности металла, образование солей может происходить с разной интенсивностью.
Участие бромоводородной кислоты в реакциях с металлами может приводить к образованию газа водорода, что может быть проиллюстрировано следующим уравнением реакции: 2HBr + Zn -> ZnBr2 + H2. Эта реакция происходит при взаимодействии бромоводородной кислоты с цинком.
Кроме того, бромоводородная кислота может вызывать коррозию металлов. При этом происходит разрушение структуры металлического материала под воздействием кислоты, что ведет к потере его физических и химических свойств.
Таким образом, бромоводородная кислота проявляет влияние на металлы в виде возможного образования солей, выделения газа водорода и вызывания коррозии. Это явление может быть использовано как в химических реакциях, так и в промышленных процессах.
Формирование солей
Взаимодействие бромоводородной кислоты с металлами может привести к образованию солей. Соли - это химические соединения, состоящие из катионов и анионов. В случае взаимодействия с металлами, катионом является металл, а анионом - бромид. Таким образом, при реакции бромоводородной кислоты с металлом образуется бромид металла.
Формула бромида металла зависит от его заряда. Если металл образует только одно положительное ионное состояние, то формула бромида совпадает с его химическим символом. Например, реакция бромоводородной кислоты с натрием приводит к образованию бромида натрия с формулой NaBr.
Однако некоторые металлы могут образовывать несколько ионных состояний и, соответственно, иметь несколько формул бромидов. Например, железо может образовывать FeBr2 и FeBr3. В таких случаях, чтобы указать заряд металла, используются римские цифры в скобках после химического символа металла. Например, бромид железа(II) имеет формулу FeBr2, а бромид железа(III) - FeBr3.
Реакция бромоводородной кислоты с различными металлами
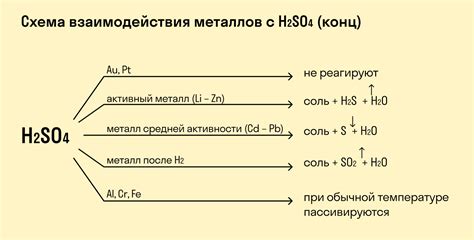
Бромоводородная кислота (HBr) является сильной минеральной кислотой и может взаимодействовать с различными металлами, образуя соли. Реакция протекает вследствие образования ионов водорода и ионов бромида. Этот процесс может быть иллюстрирован следующим образом:
- Металл образует соединение содателя соли, где замещает водородный ион (H+) в кислоте.
- В результате этой реакции выделяется молекулярный водород (H2), а неорганическая соль металла и бромид водорода (HBr) образуются:
2М + 2HBr → 2MBr + H2
Реакция бромоводородной кислоты с металлами может протекать разными способами в зависимости от характеристик и свойств металла. Например, алкалий и щелочно-земельные металлы (натрий, калий, магний, кальций и т. д.) могут реагировать с HBr очень быстро и интенсивно, выделяя большое количество водорода.
Однако, не все металлы могут взаимодействовать с бромоводородной кислотой. Некоторые металлы, такие как алюминий или серебро, не реагируют с HBr при комнатной температуре. Однако при нагревании или в других определенных условиях они также могут образовывать бромиды металлов и выделять водород.
Реакция бромоводородной кислоты с металлами имеет широкий спектр применений как в химической промышленности, так и в лабораторных условиях. Например, она может быть использована для получения бромидов металлов, которые имеют различные применения в химической синтезе и производстве различных материалов.
Реакция с щелочными металлами
Взаимодействие бромоводородной кислоты с щелочными металлами представляет собой одну из немногочисленных реакций, при которых этот галогенид может образовывать соли. Щелочные металлы (ликалии) включают натрий, калий, рубидий, цезий и франций. Их химическими свойствами обусловлено легкое образование щелочными металлами положительных ионов, что позволяет им активно реагировать с другими веществами.
Реакция хлорида водорода с щелочными металлами протекает с образованием хлоридов этих металлов и выделением водорода. Аналогично, при взаимодействии бромоводородной кислоты с щелочными металлами образуются бромиды металлов и выделяется водород. Процесс сопровождается характерными химическими реакциями и изменением физических свойств исходных веществ.
Важно отметить, что реакция бромоводородной кислоты с щелочными металлами происходит быстро, с выделением большого количества тепла. В результате могут возникать огневые и взрывоопасные ситуации, поэтому данную реакцию следует проводить с особой осторожностью и соблюдать меры безопасности.
Таблица ниже приводит примеры реакций бромоводородной кислоты с щелочными металлами:
| Щелочный металл | Продукты реакции |
|---|---|
| Натрий | Бромид натрия + Водород |
| Калий | Бромид калия + Водород |
| Рубидий | Бромид рубидия + Водород |
| Цезий | Бромид цезия + Водород |
| Франций | Бромид франция + Водород |
Таким образом, реакция бромоводородной кислоты с щелочными металлами приводит к образованию бромидов соответствующих металлов и выделению водорода. Этот процесс играет значительную роль в химии и находит применение в различных областях, в том числе в производстве химических соединений и разрушении материалов.
Реакция с щелочноземельными металлами

Щелочноземельные металлы в химии образуют группу элементов, которые расположены во второй группе периодической системы Менделеева. К ним относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы имеют сходные химические свойства и сильными основными способностями.
Реакция бромоводородной кислоты с щелочноземельными металлами протекает с образованием соответствующих бромидов и выделением водорода. Например, реакция между бромоводородной кислотой и магнием приводит к образованию бромида магния (MgBr2) и выделению молекул водорода.
Уравнение реакции:
2HBr + Mg → MgBr2 + H2
Магний является наиболее характерным представителем щелочноземельных металлов при взаимодействии с бромоводородной кислотой. Он легко реагирует с HBr, образуя бромид магния и выделяя большое количество водорода.
Другие щелочноземельные металлы, такие как бериллий, кальций и стронций, также способны реагировать с бромоводородной кислотой, образуя соответствующие бромиды и выделяя водород. Однако, эти реакции могут протекать медленнее или менее интенсивно по сравнению с реакцией магния.
Реакция с переходными металлами

Переходные металлы - это элементы, которые в периодической системе располагаются между металлами главной подгруппы и неметаллами. Взаимодействие бромоводородной кислоты с переходными металлами может протекать с образованием солей или комплексных соединений.
Бромоводородная кислота реагирует с переходными металлами, образуя соли, которые имеют характерные особенности. Например, реакция бромоводородной кислоты с железом приводит к образованию хлорида железа(III), причем в реакционной смеси образуется соляная кислота.
Взаимодействие бромоводородной кислоты с другими переходными металлами также может проходить по аналогичной схеме. Например, с хромом образуются бромид хрома(III) и соляная кислота, с никелем - бромид никеля(II) и соляная кислота, а с марганцем - бромид марганца(III) и соляная кислота.
Помимо образования солей, бромоводородная кислота может образовывать комплексные соединения с переходными металлами. Например, с медью восстанавливающей реакцией образуется комплексный ион - бромид меди(I). Если добавить в раствор этого комплексного соединения основание, то происходит процесс обратный реакции. Также происходит образование бромистых соединений с оловом, медью и другими переходными металлами.
Вопрос-ответ

Какие особенности существуют во взаимодействии бромоводородной кислоты с металлами?
Взаимодействие бромоводородной кислоты с металлами имеет свои особенности. Бромоводородная кислота является сильной кислотой и реагирует с большинством металлов. При этом образуется соль бромида металла и выделяется водород. Важно отметить, что некоторые металлы, такие как золото и платина, не реагируют с бромоводородной кислотой.
Могут ли реакции бромоводородной кислоты с металлами происходить с выделением тепла?
Реакции бромоводородной кислоты с металлами могут протекать с выделением тепла. Это происходит из-за экзотермической природы этих реакций. Выделение тепла является следствием образования соли металла и водорода. Однако не все реакции данного типа происходят с выделением тепла.
Какие реакции могут происходить между бромоводородной кислотой и металлами?
Между бромоводородной кислотой и металлами могут происходить различные реакции. Например, реакция с железом может привести к образованию соли ферро-бромида и выделению водорода. При взаимодействии с алюминием образуется соль алюмо-бромида, а водород выделяется в виде пузырьков. Кроме того, бромоводородная кислота может реагировать с цинком, свинцом и другими металлами, образуя соответствующие соли и выделяя водород.
