Реакция металлов с разбавленной серной кислотой – это химический процесс, в ходе которого происходит взаимодействие металла с серной кислотой. Такие реакции приводят к образованию солей и выделению водорода. Они являются важной частью химической образования и имеют различные закономерности и характерные свойства.
Результаты реакции металлов с разбавленной серной кислотой могут различаться в зависимости от свойств самого металла и его взаимодействия с серной кислотой. Некоторые металлы обладают высокой активностью и реагируют с серной кислотой очень быстро, при этом выделяется большое количество водорода. Другие металлы могут реагировать медленнее или даже не реагировать вообще.
Таблица свойств и результатов реакции металлов с разбавленной серной кислотой позволяет наглядно представить данные о взаимодействии различных металлов с серной кислотой. В таблице указываются названия металлов, их химические символы, способность к реакции с разбавленной серной кислотой, скорость реакции и продукты реакции. Это помогает исследователям и ученым лучше понять и прогнозировать химические процессы и их результаты.
Влияние металлов на разбавленную серную кислоту: таблица результатов и свойств

Разбавленная серная кислота, или раствор серной кислоты с небольшим количеством воды, является одним из наиболее распространенных реагентов в химических экспериментах. Она обладает высокими кислотными свойствами и может взаимодействовать с различными материалами, включая металлы.
В таблице ниже представлены результаты реакции разбавленной серной кислоты с различными типами металлов:
| Металл | Реакция с разбавленной серной кислотой |
|---|---|
| Железо (Fe) | При взаимодействии с разбавленной серной кислотой образуется сульфат железа и выделяется водород. |
| Медь (Cu) | Разбавленная серная кислота не реагирует с медью при обычных условиях. |
| Алюминий (Al) | При контакте с разбавленной серной кислотой на поверхности алюминия образуется слой оксида алюминия, который защищает металл от дальнейшей реакции. |
Металлы взаимодействуют с разбавленной серной кислотой в зависимости от их химических свойств и реактивности. Железо проявляет сильную реакцию, образуя сульфат железа и выделяя водород. Медь, напротив, не реагирует с разбавленной серной кислотой и остается неизменной. Алюминий, хотя и взаимодействует с кислотой, образует защитный слой оксида, что предотвращает дальнейшую реакцию.
Таблица результатов и свойств позволяет наглядно сравнить влияние различных металлов на разбавленную серную кислоту и понять их химические особенности. Знание этих свойств металлов позволяет использовать разбавленную серную кислоту в различных экспериментах и производственных процессах с учетом ее взаимодействия с металлами.
Реакция натрия с разбавленной серной кислотой

Натрий относится к активным металлам и проявляет реакцию с разбавленной серной кислотой. При контакте с серной кислотой, натрий происходит вступление в химическую реакцию, результатом которой является образование соли и выделение водорода.
Химическое уравнение реакции между натрием и серной кислотой выглядит следующим образом:
2Na + H2SO4 → Na2SO4 + 2H2↑
Серная кислота, H2SO4, в данной реакции выступает в роли окислителя, а натрий, Na, - восстановителя.
На протяжении реакции происходит образование соли серы и выделение молекулярного водорода. Образовавшийся водород выделяется в виде пузырьков. Это можно наблюдать благодаря газообразному продукту выделение, который является заметным при контакте с воздухом.
Таким образом, реакция натрия с разбавленной серной кислотой протекает с выделением водорода и образованием соли. Эта реакция, как и другие реакции металлов с кислотами, относится к классу реакций в которых протекает процесс окисления-восстановления.
Взаимодействие калия с разбавленной серной кислотой

Калий - щелочной металл, который активно взаимодействует со многими кислотами, включая серную кислоту. Реакция калия с разбавленной серной кислотой является эндотермической, то есть сопровождается поглощением тепла.
При взаимодействии калия с разбавленной серной кислотой образуется сульфат калия (K2SO4) и выделяется водородный газ (H2). Уравнение реакции можно записать следующим образом:
K + H2SO4 → K2SO4 + H2
Реакция проходит с различной интенсивностью в зависимости от концентрации и температуры серной кислоты. При комнатной температуре реакция протекает достаточно медленно, но её скорость можно увеличить путем нагревания смеси.
Образование водородного газа приводит к образованию физического эффекта - выделение газовой пузырьков, которые поднимаются вверх относительно металла. Это явление можно наблюдать во время реакции калия с разбавленной серной кислотой.
Химический процесс магния с разбавленной серной кислотой
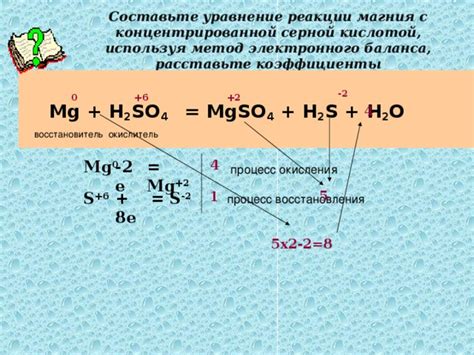
Процесс реакции магния с разбавленной серной кислотой является типичным примером химической реакции между металлом и кислотой. Он иллюстрирует основные принципы окислительно-восстановительных реакций, происходящих при контакте металла с кислотой.
Магний относится к активным металлам, что позволяет ему проявлять активные взаимодействия с кислотой. При реакции магния с разбавленной серной кислотой осуществляется окисление магния и восстановление водорода.
Уравнение реакции выглядит следующим образом: Mg + H2SO4 → MgSO4 + H2. В результате реакции образуется сульфат магния и выделяется водород газ.
Окисление магния происходит по следующим шагам: сначала магний переходит в ионную форму Mg2+, затем ион Mg2+ реагирует с ионами SO42- из серной кислоты, образуя сульфат магния MgSO4. Параллельно происходит восстановление серной кислоты с образованием молекулярного водорода H2.
Реакция магния с разбавленной серной кислотой происходит с выделением тепла и сопровождается эффектом вспышки. Образовавшийся водород газ становится видимым благодаря вспышке, так как он горит в воздухе при контакте с кислородом под действием пламени свечи или иного источника огня.
Воздействие алюминия на разбавленную серную кислоту

Алюминий является металлом, который привлекает внимание своими химическими свойствами и реактивностью. Когда алюминий взаимодействует с разбавленной серной кислотой, происходит химическая реакция, которая порождает интересные результаты.
При воздействии алюминия на разбавленную серную кислоту происходит выделение газа – диоксида серы (SO2). Данная реакция является экзотермической, то есть сопровождается выделением тепла.
Реакция заключается в том, что алюминий реагирует с серной кислотой, образуя соль алюминия и высвобождая молекулы диоксида серы. Записывается она следующим образом:
2 Al + 3 H2SO4 → Al2(SO4)3 + 3 SO2 + 3 H2O
Таким образом, происходит образование соли алюминия – сульфата алюминия (Al2(SO4)3), воды и высвобождение газообразного диоксида серы.
Данная реакция происходит быстро и является хорошо контролируемой. Результатом воздействия алюминия на разбавленную серную кислоту является образование соли, сопровождаемое выделением газа и выделением тепла. Эти результаты могут быть использованы в различных химических процессах и при производстве соответствующих продуктов.
Реактивность цинка с разбавленной серной кислотой
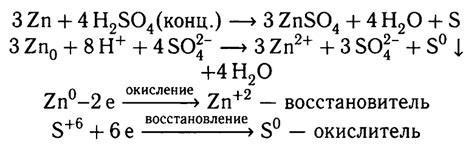
Цинк является одним из самых активных металлов и его реакция с разбавленной серной кислотой хорошо известна. При контакте цинка с серной кислотой происходит реакция, в результате которой образуется водород и сульфат цинка.
Реакция между цинком и серной кислотой является экзотермической, то есть при ее проведении выделяется тепло. При этом образующийся водород образует пузырьки и слышен характерный шипящий звук.
Уравнение реакции цинка с серной кислотой можно записать следующим образом:
Zn + H2SO4 → ZnSO4 + H2
Полученный сульфат цинка обладает белым цветом и может использоваться в различных химических процессах. Реакция цинка с разбавленной серной кислотой является одной из типичных реакций, исследуемых в химическом образовании.
Кроме того, реакция цинка с разбавленной серной кислотой является достаточно быстрой, что также является характерной особенностью данной химической реакции.
Эффект свинца на разбавленную серную кислоту

Свинец – мягкий, тяжелый и хорошо сгибаемый металл серовато-серого цвета. Он известен своей стойкостью к коррозии и является химически инертным металлом. Однако при взаимодействии с ряжением кислотами, такими как серная кислота, свинец может проявлять некоторые реактивные свойства.
В результате взаимодействия свинца с разбавленной серной кислотой происходит образование растворимой соли свинца(II) и выделение газа – сероводорода. Реакция может быть представлена следующим химическим уравнением:
Pb + H₂SO₄ → PbSO₄ + H₂↑
Сероводород обладает характерными свойствами: он обладает резким запахом, ядовит и образует с воздухом взрывоопасную смесь. Поэтому реакция свинца с разбавленной серной кислотой сопровождается характерными изменениями – образование белого и осадка и выделение газа.
Таким образом, взаимодействие свинца с разбавленной серной кислотой проявляется в образовании растворимой соли свинца(II) и выделении сероводорода. Это явление важно для понимания свойств и реакций металлов с кислотами, а также может быть использовано в индустриальных и лабораторных процессах.
Поведение железа в присутствии разбавленной серной кислоты

Железо является химическим элементом, который проявляет активное поведение при взаимодействии с разбавленной серной кислотой.
В результате контакта железа с разбавленной серной кислотой происходит химическая реакция, при которой образуется сульфат железа и выделяется водород. При этом, железо реагирует с ионами серной кислоты, что вызывает образование соответствующего сульфата. Такая реакция происходит с пропусканием большого количества тепла, что может привести к нагреванию реакционной смеси.
Железо может быть в различных степенях окисления, и его поведение в присутствии разбавленной серной кислоты зависит от этого фактора. Например, железо в степени окисления II (Fe2+) более активно реагирует с серной кислотой, по сравнению с железом в степени окисления III (Fe3+).
Реакция железа с разбавленной серной кислотой может быть использована для получения сульфата железа, который находит применение в различных отраслях промышленности, а также в медицине и сельском хозяйстве.
Реакция меди с разбавленной серной кислотой
Медь – один из наиболее активных металлов. При взаимодействии с разбавленной серной кислотой происходит образование сернокислой соли и выделение газообразного вещества – диоксида серы (IV).
Реакция начинается с момента внедрения меди в кислоту. При взаимодействии меди со средой порождается активированный комплекс, образующийся в результате притяжения и связывания атомов. В результате колебаний и перемещений атомов меди происходит отщепление электронов.
Процесс этой реакции можно назвать внешним, так как реакция происходит между двумя различными субстанциями. Когда медь взаимодействует с разбавленной серной кислотой, происходит образование ионоаэрозоля, образование значительно большей массы, чем исходные реагенты, потому что соединение между атомами серы и меди становится более прочным.
Реакция меди с разбавленной серной кислотой является экзотермической, то есть сопровождается выделением тепла. При этой реакции образуются сернокислая соль и диоксид серы (IV). Используя результаты данной реакции можно выделить диоксид серы (IV), например, воздействуя на него сульфановым раствором, при этом образуется сульфа. Кроме того, при данной реакции можно использовать медь, полученную в качестве катализатора в химическом синтезе.
Вопрос-ответ

Какие металлы реагируют с разбавленной серной кислотой?
С разбавленной серной кислотой реагируют такие металлы, как железо, цинк, алюминий, медь, никель и другие.
Что происходит при реакции металлов с разбавленной серной кислотой?
При реакции металлов с разбавленной серной кислотой образуется соль металла и выделяется водородный газ.
Какие свойства имеют соли металлов?
Соли металлов обладают такими свойствами, как электропроводность, кристаллическая структура, способность к образованию гидратов и другие характеристики, зависящие от типа металла.
Почему при реакции металлов с разбавленной серной кислотой образуется водородный газ?
При реакции металлов с разбавленной серной кислотой происходит обмен протонов между металлом и кислотой. Металл отдает электроны, образуется положительный ион металла, а серная кислота получает электроны, образуя водород. Выделение водорода в виде газа является следствием этой реакции.
