Рубидий (Rb) - металл, который относится к группе щелочных металлов. Он имеет атомный номер 37 и отличается высокой химической активностью. Рубидий является мягким, серебристым металлом, который легко реагирует с кислородом и водой. Его химические свойства определяются электронной конфигурацией и положением в периодической системе элементов.
Основной особенностью металла рубидия является его способность быстро окисляться на воздухе. Сравнительно низкая энергия ионизации обуславливает его высокую реактивность. При контакте с кислородом, рубидий образует окисел Rb2O, высокотемпературное окисление может приводить к образованию оксида RbO2. Кроме того, рубидий может образовывать другие соединения, такие как пероксиды, супероксиды и пероксичлориды, которые являются более сложными структурами.
Реакция рубидия с водой - одна из наиболее ярких характеристик его химических свойств. При взаимодействии с водой, рубидий выделяет водород и образует щелочную растворимую соль - гидроксид рубидия (RbOH). Эта реакция сопровождается выделением большого количества тепла. Кроме того, рубидий может реагировать с неорганическими кислотами, образуя соли, например, хлорид рубидия (RbCl) или нитрат рубидия (RbNO3).
Необходимо отметить, что рубидий, в отличие от более распространенного лития и калия, имеет сравнительно мало практических применений из-за своей редкости и высокой стоимости. Однако, рубидий и его соединения могут использоваться в научных исследованиях, в качестве катализаторов и в оптической промышленности.
Химические свойства металла рубидия

Рубидий – это мягкий, серо-белый металл, относящийся к группе щелочных металлов. Он обладает рядом уникальных химических свойств, которые делают его интересным объектом для исследований и применения в различных областях науки и технологий.
Первое значимое свойство рубидия – его способность активно реагировать с водой. При контакте с водой образуется щелочная растворимая смесь, включающая рубидиевую гидроксидную соль и выделяющуюся водород. Такая реакция является химически агрессивной и может сопровождаться выделением тепла.
Второе важное свойство рубидия – его высокая активность в реакциях с кислородом и азотом. Рубидий может сгорать на воздухе с образованием рубидиевого оксида или рубидиевого нитрида. Также он может образовывать соединения с другими элементами, в том числе металлами из группы переходных элементов.
Третье важное свойство рубидия – его способность образовывать сплавы и сплавы с другими металлами. Рубидий может образовывать сплавы с алюминием, никелем, цинком и другими металлами. Такие сплавы могут использоваться в различных промышленных процессах и технологиях.
Четвертое значимое свойство рубидия – его высокая электропроводность. Рубидиевые сплавы и соединения широко применяются в электротехнике и электронике. Они используются для создания электродов, контактов и других деталей, где требуется хорошая электропроводность.
Рубидий также проявляет множество других интересных химических свойств и реакций, что делает его предметом постоянного изучения и исследования.
Основные свойства металла рубидия

Металл рубидий является химическим элементом с атомным номером 37 и обозначается символом Rb.
Основным свойством рубидия является его высокая реактивность. Он обладает мягкой текстурой и серебристо-белым металлическим блеском.
Металл рубидий постепенно окисляется на воздухе, при этом образуется оксид рубидия, который является белым кристаллическим веществом. Поэтому для предотвращения окисления рубидия его часто хранят в сосудах с инертной газовой средой или под слоем жидкого пара рубидия.
Рубидий реагирует с водой очень быстро и образует гидроксид рубидия и водород. При этом происходит выделение большого количества тепла. Реакция рубидия с водой может быть настолько интенсивной, что металл может искриться и даже воспламеняться.
Рубидий также образует реакции с кислородом, аммиаком, галогенами и серой, образуя соответствующие оксиды, нитриды, галогениды и сульфиды рубидия.
Кроме того, рубидий способен образовывать сплавы с другими металлами, такими как натрий, калий, кальций и алюминий. Эти сплавы используются в различных областях техники и промышленности.
Кристаллическая структура рубидия
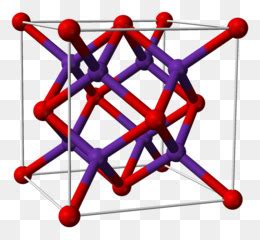
Рубидий относится к щелочным металлам и обладает характерной кристаллической структурой. Кристаллическая структура рубидия группируется в простую кубическую решетку, в которой каждый атом рубидия окружен восемью ближайшими атомами. Эта упорядоченная структура обуславливает особенности химических свойств рубидия и его способность к реакциям с другими веществами.
Простая кубическая решетка рубидия обладает высокой плотностью и твердым состоянием при комнатной температуре и давлении. Атомы рубидия в кристалле расположены в узлах решетки, образуя регулярную фигуру. Эта структура делает кристаллы рубидия прозрачными и позволяет им переходить в пластичное состояние при нагревании.
Химические свойства рубидия, такие как его высокая активность и реакционная способность, связаны с особенностями кристаллической структуры. Атомы рубидия, окруженные другими атомами в решетке, легко взаимодействуют с внешними веществами и могут образовывать разнообразные соединения.
Кристаллическая структура рубидия является одной из основных характеристик металла и влияет как на его физические, так и на химические свойства. Изучение кристаллической структуры рубидия позволяет лучше понять его поведение в различных условиях и взаимодействие с другими веществами.
Физические свойства рубидия

Рубидий является мягким и легким металлом, который легко соединяется с другими элементами. Его плотность составляет около 1,53 г/см³, что делает его скользким при касании. Рубидий является одним из самых легких металлов, и его плотность ниже, чем у воды.
Рубидий имеет серый металлический цвет и является хорошим проводником электричества и тепла. Он имеет низкую температуру плавления - всего 39 градусов Цельсия, что делает его одним из элементов, которые плавятся при низких температурах. Тем не менее, рубидий может испаряться и переходить в газообразное состояние при комнатной температуре.
Рубидий является химически активным металлом, который реагирует с кислородом, водой и многими органическими соединениями. Он образует оксид рубидия (RuO₂), который является стабильным воздуху и не реагирует с водой. Кроме того, рубидий реагирует с галогенами, образуя галогениды рубидия.
Одной из интересных физических свойств рубидия является его способность вступать в реакцию с воздухом и образовывать оксид рубидия (RuO₂). Это делает рубидий полезным материалом для использования в батареях, так как оксид рубидия может служить в качестве электрода. Кроме того, рубидий используется в фотоэлектрических устройствах и при создании лазеров.
Взаимодействие рубидия с кислородом

Металл рубидий активно взаимодействует с кислородом, образуя оксид рубидия (Ru2O). Это оксид является темновато-коричневым порошком и обладает высокой температурой плавления, которая составляет примерно 1300°C.
При нагревании рубидия на воздухе он начинает окисляться, и на его поверхности образуется тонкая пленка оксида рубидия. Этот процесс сопровождается выделением интенсивного красного пламени и характерным треском.
Оксид рубидия является нерастворимым в воде, но растворим в кислотах. При контакте с водой он гидролизуется, образуя гидроксид рубидия (RuOH) и высвобождая молекулы водорода (Н2).
Гидроксид рубидия сильно щелочной и используется в химической промышленности как катализатор при производстве различных органических соединений.
Возможными реакциями рубидия с кислородом являются также образование пероксида рубидия (Ru2O2) и супероксида рубидия (RuO2). Пероксид рубидия, как и пероксид калия, обладает окислительными свойствами и может применяться как кислорододержащий средник в химической промышленности.
Таким образом, взаимодействие рубидия с кислородом является химическим процессом, приводящим к образованию различных оксидов и гидроксидов рубидия, которые находят применение в различных областях промышленности и научных исследований.
Реакция рубидия с водой

Рубидий – химический элемент из группы щелочных металлов, обладающий высокой реактивностью. Его реакция с водой является одной из самых сильных среди металлов группы. При контакте рубидия с водой происходит взрывообразное реакционное взаимодействие.
Вода амфотерна, и рубидий активно взаимодействует как с водой, так и с кислородом в ней. В результате рубидий и вода превращаются в оксид рубидия и водород. Химическое уравнение данной реакции можно записать следующим образом:
2Rb + 2H2O → 2RbOH + H2
Реакция рубидия с водой является экзотермической, то есть сопровождается выделением значительного количества тепла. При этом выделяющийся водород образует газовую смесь с водяными пароми, которая может воспламеняться в результате искрения или другого источника огня. Поэтому такую реакцию рубидия с водой не рекомендуется проводить самостоятельно без специальных мер предосторожности.
Интересно отметить, что реакция рубидия с водой схожа с реакцией других щелочных металлов, в частности, лития, натрия и калия. Однако рубидий более активен и взрывоопасен, поэтому требует особой осторожности при обращении.
Реакция рубидия с галогенами
Рубидий — это щелочной металл, который обладает активными химическими свойствами и способен реагировать с различными веществами. Одной из важных групп веществ, с которыми рубидий может реагировать, являются галогены. Галогены включают фтор, хлор, бром и йод, и каждый из них имеет схожие, но все же отличающиеся химические свойства.
Реакция рубидия с галогенами обычно происходит с образованием рубидиевых галогенидов. При контакте с фтором, рубидий образует рубидиевый фторид (RbF), с хлором — рубидиевый хлорид (RbCl), с бромом — рубидиевый бромид (RbBr), а с йодом — рубидиевый йодид (RbI).
Реакция рубидия с галогенами обычно протекает с выделением значительного количества тепла и образованием ярких пламен. Это объясняется высокой активностью рубидия и его способностью легко отдавать электроны другим элементам.
Важно отметить, что рубидиевые галогениды обладают разными свойствами. Например, рубидиевый фторид является растворимым в воде, тогда как рубидиевый хлорид, бромид и йодид растворяются в воде только при нагревании.
Реакция рубидия с галогенами является одной из важных реакций, которые обусловливают использование рубидия в различных областях, таких как фототехника, лазерная технология, радиоактивные источники и реактивы в химическом исследовании.
Вопрос-ответ

Как рубидий реагирует с кислородом?
Рубидий является очень активным металлом и быстро окисляется на воздухе. При контакте с кислородом образуется оксид рубидия, который представляет собой темно-синюю кристаллическую субстанцию: 4Rb + O2 -> 2Rb2O. Оксид рубидия реагирует с водой, образуя гидроксид рубидия: Rb2O + H2O -> 2RbOH.
Какие соединения может образовывать рубидий?
Рубидий образует соединения с различными элементами, обычно валентность которых равна 1. Например, рубидий образует галогениды (соединения с фтором, хлором, бромом и иодом), оксиды (с кислородом), сульфиды (с серой), нитриды (с азотом) и т.д. Рубидий также образует стабильные соединения с аммиаком и некоторыми органическими соединениями.
