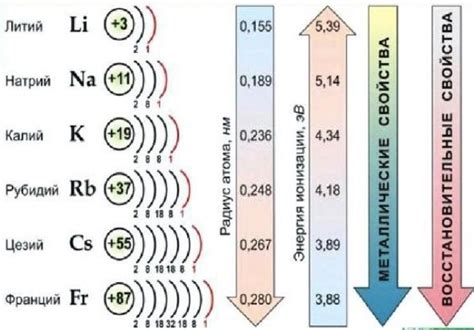
Щелочные металлы – это элементы группы I периодической таблицы Менделеева, которые обладают рядом общих химических свойств. Самыми известными представителями данного семейства являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Химические свойства щелочных металлов объясняются их электронной структурой – каждый атом содержит один электрон во внешней оболочке. Это делает их очень реакционноспособными элементами, проявляющими сильное химическое взаимодействие с другими веществами.
Одним из ключевых свойств щелочных металлов является их способность образовывать сильно основные гидроксиды, т.е. гидроксиды, которые обладают высокой щелочностью. Это обстоятельство определяет их важность в химической промышленности и в различных химических реакциях.
Анализ семейства щелочных металлов
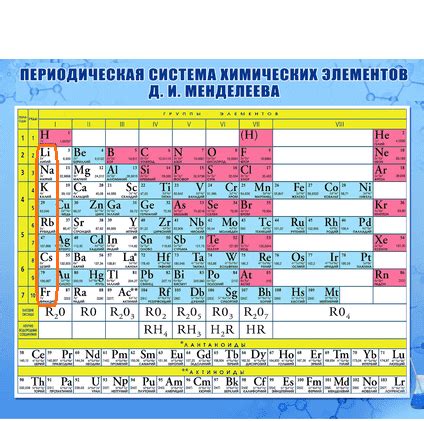
Семейство щелочных металлов включает элементы с химическими свойствами, общими для этой группы. Щелочные металлы характеризуются высокой реактивностью, низкой температурой плавления и кипения, а также способностью образовывать ионы с положительным зарядом. Они легко реагируют с водой, образуя щелочные растворы и выделение водорода.
Важными представителями семейства щелочных металлов являются литий, натрий, калий, рубидий, цезий и франций. Каждый из этих элементов имеет свои особенности в химическом поведении, но общие черты всё равно присутствуют у всех членов этой группы.
Изучение свойств и реакций щелочных металлов позволяет проводить более глубокий анализ и понимание химических процессов, в которых они участвуют. Это семейство элементов играет важную роль в химической промышленности и науке, что делает его объектом внимания многих исследователей и химиков.
Уникальные химические свойства

Щелочные металлы обладают рядом уникальных химических свойств, которые делают их особыми среди других элементов:
| 1. | Сильная реакция с водой. Щелочные металлы (например, натрий, калий) реагируют с водой, выделяя водород и образуя щелочной гидроксид. |
| 2. | Высокая реакционная способность. Щелочные металлы легко образуют ионы с положительным зарядом, что делает их активными химическими элементами. |
| 3. | Хорошая проводимость электричества. Щелочные металлы являются хорошими проводниками электричества благодаря своей способности образовывать ионы. |
Физические характеристики элементов
Семейство щелочных металлов включает в себя элементы с очень низкой плотностью и низкой температурой плавления, что делает их мягкими и легкими металлами. Они обладают химической активностью, легко реагируют с водой и кислородом.
Например, литий (Li) имеет плотность всего 0,53 г/см³, а его температура плавления составляет 180,54°C. Натрий (Na), который является более известным элементом, имеет плотность 0,97 г/см³ и температуру плавления 97,8°C.
Калий (K) также характеризуется низкой плотностью (0,86 г/см³) и низкой температурой плавления (63,5°C). Рубидий (Rb) и цезий (Cs) имеют схожие физические свойства с другими элементами семейства щелочных металлов.
Объединяет эти элементы высокая реактивность, что делает их важными компонентами в различных отраслях химии и технологий.
Реактивность и взаимодействие
Неравновесие в реакциях щелочных металлов может привести к взрывчатым результатам, поэтому они должны храниться в специальных условиях, чтобы избежать непредвиденных последствий. Кроме того, щелочные металлы могут реагировать с кислородом в воздухе, образуя оксиды металлов, что может привести к образованию оксидов загрязнения воздуха.
Применение в промышленности

Семейство щелочных металлов широко применяется в промышленности как сырье для производства различных веществ. Натрий, калий, рубидий и цезий находят применение в производстве щелочных металлов, щелочных электролитов, керамических и стеклянных материалов, а также в процессах плавления металлов. Они также используются в производстве лекарств, удобрений, пищевых добавок и других продуктов.
Влияние на окружающую среду

Семейство щелочных металлов оказывает значительное влияние на окружающую среду. Некоторые из них, такие как натрий и калий, широко используются в промышленности, сельском хозяйстве, медицине и других областях. Это может вызывать проблемы с загрязнением почвы и воды, а также отходами производства.
Кроме того, высокая реактивность щелочных металлов может привести к опасным реакциям, особенно при неправильном хранении или использовании. Например, реакция лития с водой может вызвать пожар или взрыв. Поэтому необходимо соблюдать осторожность при работе с этими веществами.
Перспективы развития щелочных металлов
С развитием глобальной энергетики и электромобильности спрос на щелочные металлы будет продолжать расти. Использование лития, натрия и других щелочных металлов в аккумуляторах обеспечивает эффективное хранение энергии.
Исследования в области новых материалов и технологий позволят улучшить производство щелочных металлов, сделать их более экологически безопасными и эффективными.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа элементов периодической системы, которая включает литий, натрий, калий, рубидий, цезий и франций. Они характеризуются активностью и реакционностью, а также обладают сходными химическими свойствами, такими как легкость образования ионов с положительным зарядом.
Почему считается, что щелочные металлы обладают сходными химическими свойствами?
Считается, что щелочные металлы обладают сходными химическими свойствами из-за их общей электронной структуры. Все они имеют один валентный электрон во внешней оболочке и стремятся избавиться от него, образуя ионы с однозначным положительным зарядом. Это обуславливает их схожие химические реакции и свойства.