Атомный радиус играет важную роль в химии и физике, определяя размер и взаимное расположение атомов в молекулах и кристаллических структурах.
Магний и натрий – два металла, обладающие различными химическими и физическими свойствами, включая разницу в атомных радиусах.
Сравнение значения атомных радиусов магния и натрия позволяет лучше понять их химическое поведение и взаимодействия с другими элементами.
Сравнение атомного радиуса магния и натрия

Атомный радиус магния составляет около 160 пикометров, тогда как у натрия он равен примерно 185 пикометрам.
Магний имеет меньший атомный радиус по сравнению с натрием, что связано с его большим зарядом ядра и более плотной структурой.
Таким образом, натрий имеет более крупный размер атома, чем магний, что оказывает влияние на их химические свойства и способность к образованию соединений.
Магний: свойства и химический элемент

Основные свойства магния:
- Отличается низкой плотностью и хорошей пластичностью;
- Хорошо растворим в кислотах;
- Обладает высокой теплопроводностью и электропроводностью;
- Подвержен окислению на воздухе, образуя защитную пленку оксида на поверхности.
Магний широко используется в различных отраслях промышленности: от производства автомобилей и самолетов до производства лекарственных препаратов. Его соединения применяются в производстве пиротехники, спортивного снаряжения и в других отраслях.
Натрий: области применения и основные характеристики

Основные области применения натрия:
- Производство пищевых продуктов, так как натрий используется в процессах консервирования и добавляется в различные продукты для поддержания баланса жидкости в организме;
- Производство щелочи, которая используется в промышленности для очистки и обезжелезивания воды;
- Производство соли – хлорида натрия, широко используемого в пищевой, химической и фармацевтической промышленности;
- Производство легких металлических сплавов для авиационной и космической техники;
- Производство органических соединений и медикаментов.
Основные характеристики натрия: мягкий и легкий металл с серебристо-белым оттенком, реакционноспособен, легко окисляется на воздухе, хорошо растворяется в воде, обладает низкой плотностью и температурой плавления.
Атомный радиус магния: определение и значение
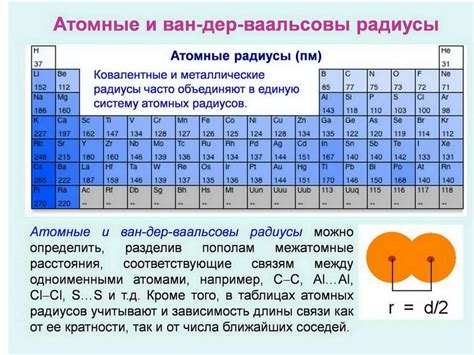
Обычно атомный радиус магния составляет примерно 160 пикометров (1 пикометр = 10^-12 метра), что делает его одним из больших по размеру элементов в периодической таблице. Благодаря своему относительно большому размеру, атом магния может образовывать стабильные соединения с различными элементами, что делает его важным компонентом многих природных и промышленных соединений.
Атомный радиус натрия: способы измерения и сравнение
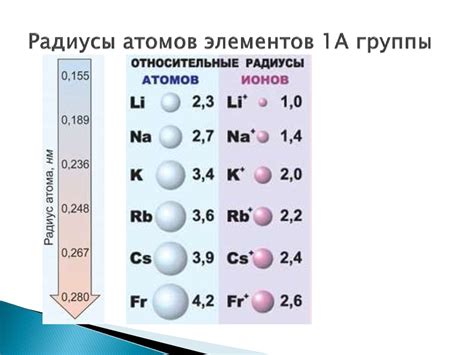
Способы измерения:
- Рентгеноструктурный анализ: Метод основан на анализе дифракции рентгеновских лучей на кристаллической решетке натрия. Этот метод позволяет определить расстояние между атомами и, следовательно, атомные радиусы.
- Определение координационного числа: В химии координационное число атома указывает, сколько атомов других элементов окружают его. Основываясь на этом, можно определить атомный радиус натрия.
Сравнение с другими элементами:
Сравнивая атомный радиус натрия с радиусом других элементов, можно заметить, что, например, у натрия радиус меньше, чем у магния (Mg). Это может иметь важное значение при изучении химических свойств и взаимодействий этих элементов.
Факторы, влияющие на атомные радиусы магния и натрия

Атомные радиусы магния и натрия зависят от нескольких факторов, таких как:
- Число электронов внешней оболочки: чем больше у атома электронов, тем больше его атомный радиус.
- Заряд ядра: чем больше заряд у ядра атома, тем сильнее оно притягивает электроны и меньше будет атомный радиус.
- Степень экранировки: электроны внутренних оболочек экранируют заряд ядра от внешних электронов, влияя на атомный радиус.
Эти факторы в совокупности определяют относительные значения атомных радиусов магния и натрия, а именно что радиус натрия меньше радиуса магния из-за различий в заряде ядра и числе электронов внешней оболочки.
Итак, сравнивая атомные радиусы магния и натрия, мы видим, что атомный радиус магния (150 пикометров) оказывается значительно меньше атомного радиуса натрия (186 пикометров). Эти различия можно объяснить структурой электронных оболочек и зарядом ядра атома.
Магний, будучи элементом с большим зарядом ядра и меньшим числом электронов, имеет более сжатую электронную оболочку, что делает его атомный радиус меньше. Натрий же имеет большее количество электронов и, следовательно, более развитую электронную оболочку, в результате чего его атомный радиус больше.
Таким образом, изучение атомных радиусов магния и натрия позволяет понять важное свойство элементов периодической таблицы, влияющее на физико-химические характеристики веществ. Описанные особенности атомных радиусов представляют собой ключевые моменты для понимания химических процессов, в которых участвуют атомы данных элементов.
Вопрос-ответ

Какой атомный радиус у магния и натрия?
Атомный радиус магния составляет около 160 пикометров, в то время как атомный радиус натрия равен примерно 186 пикометров. Это означает, что атомы натрия имеют больший размер, чем атомы магния.
Чем объясняется разница в атомных радиусах магния и натрия?
Разница в атомных радиусах магния и натрия обусловлена электронной конфигурацией атомов. Атом натрия имеет большее количество электронов и показывает характеристики большего радиуса по сравнению с атомом магния, у которого меньше электронов.
Какие свойства элементов зависят от их атомного радиуса?
Атомный радиус элементов определяет такие свойства, как химическая реактивность, размер молекул и кристаллических решеток, возможность образования химических связей. Например, больший атомный радиус натрия может влиять на его активность в химических реакциях.
Каково значение знания атомных радиусов для химии?
Знание атомных радиусов имеет большое значение для понимания структуры и свойств веществ. Оно помогает химикам предсказывать поведение элементов в соединениях, определять типы химических связей, разрабатывать новые материалы и многое другое.



