Нитритная кислота (HNO2), представляющая собой слабую кислоту, является важным химическим соединением, активно используемым в различных областях науки и промышленности. Свойства HNO2 определяют его широкий спектр применений и влияние на химические процессы.
Высокая реакционная способность HNO2 делает его ценным реагентом в органическом синтезе и аналитической химии. При этом нитритная кислота обладает специфическими свойствами, которые отличают ее от других кислот и соединений.
Узнать больше о свойствах и применении HNO2 поможет более детальное изучение данного вещества и его роли в химических процессах. Изучение химии HNO2 является важным шагом для понимания многих аспектов современной науки и технологий.
Химическое вещество HNO2: общая информация
Химическое вещество HNO2, известное как азотистая кислота, представляет собой нестабильное соединение, которое получают в виде бесцветных кристаллов или ярко-желтой жидкости в виде раствора.
Физические свойства: температура плавления -11,2 °C, температура кипения 79,8 °C. Химическая формула HNO2.
Химические свойства: азотистая кислота обладает окислительными и восстановительными свойствами, легко дезаминируется в азотную кислоту. Химическое вещество HNO2 используется в органическом синтезе и как дезинфицирующее средство.
Описание, состав и строение
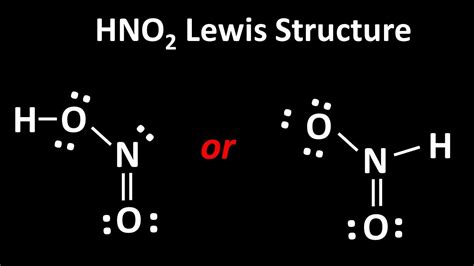
Химическое вещество HNO2, или азотистая кислота, состоит из азота, кислорода и водорода. Его молекулярная формула представляется как HNO2. Азотистая кислота имеет бесцветную или слабо-желтоватую жидкую структуру.
Строение молекулы HNO2 состоит из азота, который соединен с одним атомом водорода и с двумя атомами кислорода. Атом азота образует две ковалентные связи с кислородом и одну с водородом.
| Элемент | Количество атомов |
|---|---|
| Азот (N) | 1 |
| Кислород (O) | 2 |
| Водород (H) | 1 |
Физические свойства HNO2

Химическое вещество HNO2, или азотистая кислота, представляет собой безцветную слабокислую жидкость с резким запахом. Ее плотность составляет около 1,45 г/см³ при комнатной температуре. HNO2 легко растворяется в воде, образуя кислую среду.
Точка плавления азотистой кислоты составляет -9,4°C, а точка кипения - 70,1°C. HNO2 является неустойчивым и легко разлагается при нагревании или хранении: при этом выделяется красноватый газ NO2.
Способность HNO2 взаимодействовать с другими веществами зависит от ее концентрации и условий окружающей среды. При реакции с металлами и основаниями азотистая кислота может образовывать соли и азиды.
| Плотность | 1,45 г/см³ |
| Температура плавления | -9,4°C |
| Температура кипения | 70,1°C |
Температура кипения и кристаллическая структура
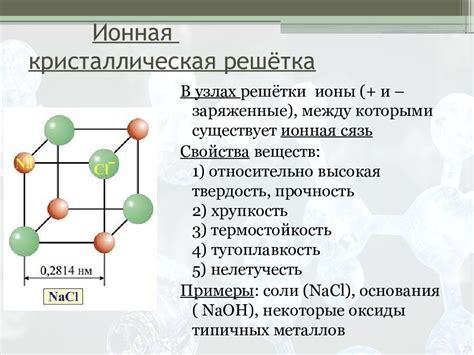
Химическое вещество HNO2 имеет температуру кипения равную 72 °C. При данной температуре происходит переход вещества из жидкого состояния в газообразное. Кристаллическая структура HNO2 характеризуется тем, что вещество образует кристаллы с упорядоченной молекулярной узорной структурой. Кристаллическая форма HNO2 определяет его физические и химические свойства, что необходимо для использования в различных процессах и реакциях.
Химические свойства HNO2

Химическое вещество HNO2, или азотистая кислота, представляет собой слабую кислоту, которая легко распадается при нагревании или при воздействии света. HNO2 обладает специфическими химическими свойствами, включающими реакции окисления и восстановления.
Основные химические свойства HNO2:
| 1. Окислительные свойства | Азотистая кислота обладает окислительными свойствами и способна окислять многие органические вещества. Например, она может окислять сероводород до серы, алкены до диола и др. |
| 2. Реакция с сильными основаниями | HNO2 реагирует с сильными щелочами, образуя азотиты. Например, с каустической содой NaOH образуется натриевый азотит NaNO2. |
| 3. Декомпозиция | При нагревании азотистая кислота легко распадается на воду и азот(II) окись. |
Взаимодействие с другими веществами и реактивность
Химическое вещество HNO2 обладает высокой реактивностью и способно взаимодействовать с различными соединениями. В присутствии кислорода HNO2 может распадаться с образованием газообразного NO и NO2. Сильные окислители, например, перманганат калия, могут привести к окислению HNO2 до HNO3.
С металлами HNO2 также может реагировать, образуя соответствующие нитриты. Например, с медью в результате реакции образуется нитрит меди.
Интенсивность реакций HNO2 с различными веществами зависит от условий проведения реакции и соотношения реагентов, что определяет её кинетику и продукты.
Применение HNO2
Кислота HNO2 широко применяется в химической промышленности и лабораториях. Некоторые основные области ее применения:
| 1. | Используется в качестве окислителя в различных химических реакциях. |
| 2. | Применяется для синтеза органических соединений и производства лекарственных препаратов. |
| 3. | Используется как реагент при проведении аналитических исследований. |
| 4. | Используется для консервирования питьевой воды и контроля за качеством воды в бассейнах. |
Благодаря своим свойствам и высокой реакционной способности, HNO2 играет важную роль в химической промышленности и научных исследованиях.
Вопрос-ответ

Что такое химическое вещество HNO2?
Химическое вещество HNO2 представляет собой азотистую кислоту, которая является слабой кислотой со сложной структурой и свойствами.
Каковы основные свойства HNO2?
HNO2 обладает ярко выраженным свойством легкоразлагаемости, плохо стабилен и имеет слабый слабоокисляющий характер. Оно также является окислителем в реакциях с различными веществами.
Какие применения имеет HNO2?
HNO2 используется в химической промышленности для синтеза различных органических соединений, в производстве красителей и лекарственных препаратов. Также его используют в аналитической химии для определения содержания аминов и других органических соединений.
Какие опасности связаны с использованием HNO2?
HNO2 является токсичным веществом и может быть опасным при контакте с кожей, глазами или при вдыхании паров. Необходимо соблюдать меры предосторожности при работе с ним, использовать защитное снаряжение и выполнять все рекомендации по безопасному обращению.