Одним из фундаментальных принципов, лежащих в основе химических реакций, является закон взаимодействия количества веществ в кратком координатном пространстве. Этот закон результат объединения и взаимодействия молекул, атомов и ионов в химической системе. Он отражает глубокую взаимосвязь между различными веществами и определяет, какое количество веществ участвует в реакции.
Закон взаимодействия количества веществ в кратком координатном пространстве имеет большое значение при изучении химических реакций и процессов. Он позволяет определить, сколько реагентов необходимо для получения определенного количества продуктов и предсказать, как изменится количество веществ в результате реакции. Это основа для точного расчета стехиометрических соотношений и определения реакционной энергии.
Примером применения закона взаимодействия количества веществ в кратком координатном пространстве может служить реакция сжигания углеводородов. При сжигании одного моля углеводорода с участием кислорода образуется определенное количество углекислого газа и воды. Это соотношение можно предсказать именно благодаря закону взаимодействия количества веществ, который показывает, что один моль углеводорода требует точно такое же количество кислорода для полного сгорания, и продукты реакции образуются в определенных пропорциях.
Основные принципы закона активности в реакциях химических веществ
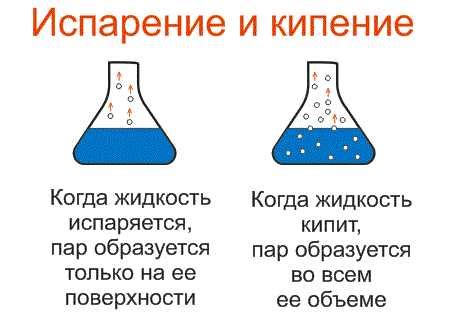
Коэффициент активности – ключевая концепция закона активности. Он позволяет оценить, насколько вещество активно участвует в реакции, учитывая его концентрацию и физико-химические свойства. Когда в системе присутствуют различные компоненты, величина коэффициента активности может меняться в зависимости от условий реакции.
Равновесная концентрация – еще один важный принцип, связанный с законом активности. Она определяет конечное состояние системы после завершения реакции и характеризуется с помощью равновесной постоянной. Равновесная концентрация позволяет определить, какие вещества преобладают в системе, а также предсказать направление перемещения равновесия при изменении условий реакции.
Понимание сути принципа химической реакции через определение закона активности вещества
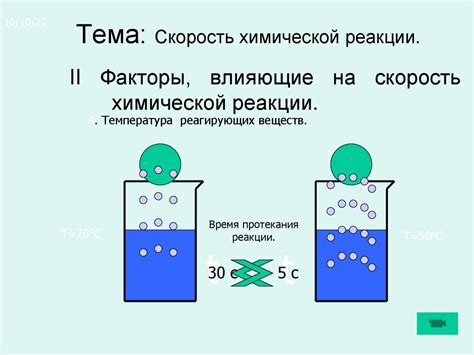
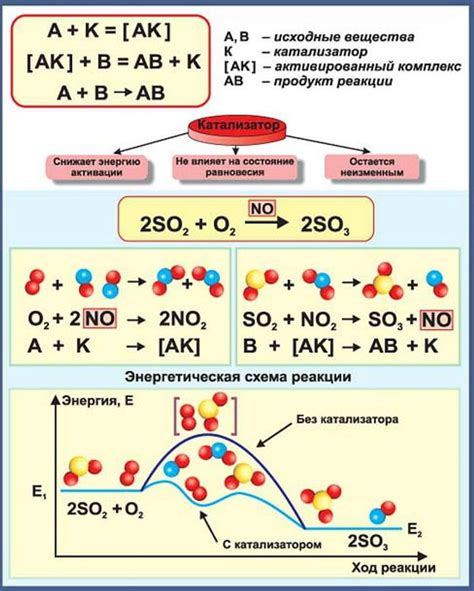
В основе закона активности лежит представление о взаимодействии веществ в реакции в зависимости от их концентраций. Согласно этому закону, скорость химической реакции пропорциональна произведению активностей реагентов, повышение концентрации которых приводит к ускорению химической реакции. Таким образом, определение закона активности позволяет понять, как изменение концентрации влияет на темп реакции и ее продвижение вправо или влево.
Например, рассмотрим реакцию между водородом и кислородом:
2 H2 + O2 → 2 H2O
Согласно закону активности, концентрация водорода и кислорода будет определять скорость этой реакции. Если увеличить концентрацию водорода или кислорода, то скорость образования воды также увеличится. Важно отметить, что изменение концентрации реагентов может изменить равновесие реакции, то есть соотношение между реагентами и продуктами.
Таким образом, определение закона активности вещества является ключевым для объяснения и прогнозирования химических реакций. Понимание влияния концентрации на скорость реакции и равновесие помогает установить связь между условиями проведения реакции и ее результатами.
Принцип физического взаимодействия в системе реакции веществ
В данном разделе рассмотрим фундаментальный принцип, лежащий в основе физического взаимодействия в системе реакции веществ. Мы изучим взаимодействие частиц вещества и его реакционную способность, обсудим основные принципы, которые определяют поток и скорость химических реакций.
Одно из ключевых понятий, которое мы будем рассматривать, – это взаимодействие молекул и атомов вещества. В процессе реакции вещества, они обмениваются энергией и частицами между собой, создавая новые соединения и разрушая старые. Этот процесс подчиняется определенным физическим законам, которые управляют потоком и направлением реакции.
Основной принцип, на котором основано физическое взаимодействие в системе реакции веществ, – это принцип действия и противодействия взаимодействующих частиц. Он утверждает, что каждая частица вещества в системе реакции оказывает влияние на другие частицы, а также испытывает воздействие со стороны них. Это взаимодействие между частицами вещества определяет их реакционную способность и уровень активности.
Важно отметить, что принцип физического взаимодействия в системе реакции веществ применим к различным типам химических реакций. От обратимых реакций до однонаправленных процессов, этот принцип играет решающую роль в определении химического равновесия и скорости реакции. Он предоставляет нам ключевые инструменты для понимания и изучения механизмов, лежащих в основе химических процессов.
Условия применимости закона активности в химии: общая картина

Первое условие – наличие достаточного количества заряженных частиц в реакциях. Такие частицы являются активными участниками химических процессов и могут образовывать ионы или комплексы. В отсутствие заряженных частиц, закон активности не применим.
Второе условие – разбавленность реакционной среды. Если концентрация реагентов и продуктов реакций достаточно высока, то их взаимодействие становится более активным, а следовательно, такие системы не подчиняются закону активности.
Третье условие – учитывание ионной силы раствора. Ионная сила является параметром, учитывающим взаимодействие линейной концентрации ионов различного заряда. В растворе, где ионная сила отличается от нуля, применение закона активности требует дополнительных модификаций.
| Условие | Объяснение |
|---|---|
| Наличие заряженных частиц | Заряженные частицы являются активными участниками реакций |
| Разбавленность реакционной среды | Высокая концентрация не позволяет применять закон активности |
| Учет ионной силы раствора | Ионная сила влияет на применимость закона активности в растворах |
Применение принципа массового действия в химических реакциях: убедительные примеры
| Пример 1: Горение | Пример 2: Растворение | Пример 3: Синтез |
|---|---|---|
| Когда вещество горит, его масса уменьшается, а рост массы окружающего воздуха свидетельствует о присоединении кислорода. Например, при горении древесных опилок в закрытой системе, масса опилок уменьшается, а масса закрытой системы, включая воздух, увеличивается. | При растворении реагента в растворителе можно ожидать определенное соотношение между массой растворенного вещества и объемом раствора. Например, при растворении соли в воде, масса соли будет пропорциональна объему раствора. | В химических синтезах, масса реагентов, добавленных в реакционную смесь, должна быть пропорциональна массе получаемого продукта. Например, при синтезе аммиака из азота и водорода, масса азота и водорода, вступающих в реакцию, должна соответствовать массе полученного аммиака. |
Таким образом, применение принципа массового действия позволяет определить соотношения между массами реагентов и продуктов в химических реакциях. Этот принцип является основополагающим для понимания и прогнозирования химических процессов и находит широкое применение в различных отраслях науки и промышленности.
Вопрос-ответ

Что такое закон действующих масс в химии?
Закон действующих масс в химии утверждает, что скорость химической реакции пропорциональна произведению активностей или концентраций реагентов, возведенных в степень, равную их стехиометрическому коэффициенту в уравнении реакции.
Как можно объяснить закон действующих масс в химии на практике?
Допустим, у нас есть химическая реакция с участием двух реагентов А и В. Их концентрации влияют на скорость реакции. Если мы увеличим концентрацию реагента А, то скорость реакции также увеличится. Однако, увеличение концентрации реагента В может оказывать более сильное влияние на скорость реакции. Закон действующих масс помогает определить, какие реагенты вносят наибольший вклад в скорость реакции.
Какие примеры можно привести для наглядного объяснения закона действующих масс в химии?
Один из наиболее известных примеров - это горение. Реакция горения протекает при участии кислорода и топлива, например, газа. Если увеличить концентрацию кислорода, скорость горения увеличится, поскольку кислород является реагентом. То же самое касается и изменения концентрации топлива. Если увеличить его концентрацию, скорость горения также увеличится. В обоих случаях закон действующих масс позволяет определить, какие реагенты вносят наибольший вклад в скорость горения.



