Электролитическая диссоциация - важное явление в химии, касающееся распада электролитов на ионы в растворе. Это процесс, который позволяет понять поведение различных веществ в растворе и их взаимодействие с другими компонентами.
Важной характеристикой электролитической диссоциации является степень диссоциации, которая отражает долю молекул электролита, которые распадаются на ионы при ее растворении. Степень диссоциации зависит от концентрации раствора, температуры и свойств самого электролита.
Изучение электролитической диссоциации позволяет лучше понять химические реакции, происходящие в растворах, и оценить степень активности различных соединений. Это важно как для теоретического понимания химических процессов, так и для практического применения при проведении лабораторных исследований.
Электролитическая диссоциация:
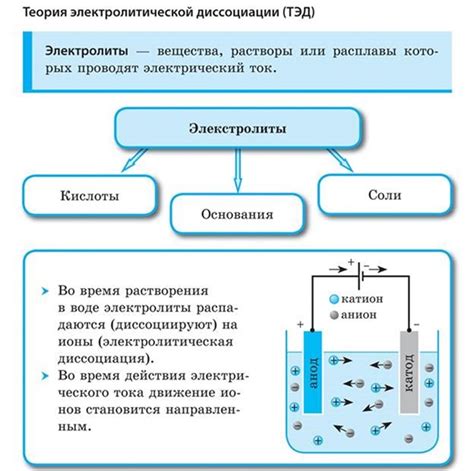
Степень диссоциации определяет, какая часть молекулы соединения расщепляется на ионы. Степень диссоциации может быть полной, когда все молекулы разделяются на ионы, или частичной, когда только часть молекул диссоциирует.
Важно отметить, что электролитическая диссоциация играет ключевую роль в проведении электролиза и в ряде других химических процессов.
Определение и суть
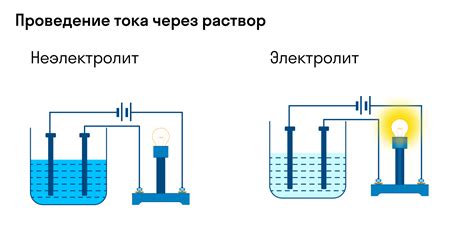
Степень диссоциации электролита определяет, насколько полная или частичная происходит разделение на ионы. Этот процесс играет важную роль в химии и является фундаментальным для понимания многих химических реакций.
Примеры и виды электролитической диссоциации
| Вид электролита | Пример |
|---|---|
| Сильные электролиты | Серная кислота (H2SO4) – диссоциирует по всем компонентам: 2H2SO4 → 2H+ + SO4^2- |
| Слабые электролиты | Уксусная кислота (CH3COOH) – диссоциирует незначительно: CH3COOH ⇄ H+ + CH3COO- |
| Электролиты в растворе | Купорос (CuSO4) – в растворе диссоциирует на Cu^2+ и SO4^2- |
Факторы влияющие на степень диссоциации

1. Температура:
Повышение температуры обычно увеличивает степень диссоциации, так как высокая энергия позволяет молекулам преодолевать энергетический барьер и распадаться на ионы.
2. Плотность раствора:
Увеличение концентрации раствора обычно увеличивает степень диссоциации, так как большее количество молекул приводит к более частым столкновениям и распаду на ионы.
3. Полярность растворителя:
Полярные растворители могут способствовать более эффективной диссоциации сильных электролитов, поскольку они могут образовывать устойчивые взаимодействия с ионами.
4. Величина заряда и тонность ионов:
Чем больше заряд ионов и чем меньше их радиус, тем выше степень диссоциации, так как сильные взаимодействия между ионами искажают структуру раствора и способствуют их разделению.
Значение для химических реакций
Электролитическая диссоциация играет важную роль в химических реакциях. Поскольку ионы, образующиеся в результате диссоциации, обладают зарядом, они могут участвовать в различных реакциях, в том числе в качестве реактивов или продуктов. Это позволяет контролировать процессы химической реакции, увеличивать скорость реакции и оптимизировать условия проведения.
Знание степени диссоциации электролита позволяет предсказать химическое поведение вещества, его растворимость, pH растворов и другие ключевые характеристики. Понимание процесса электролитической диссоциации необходимо для понимания многих аспектов химии и является основой для изучения реакций в растворах.
Вопрос-ответ

Что такое электролитическая диссоциация?
Электролитическая диссоциация - это процесс расщепления ионных соединений на ионы в растворе под действием электрического тока. В результате этого процесса образуются положительно и отрицательно заряженные ионы, способные проводить электрический ток.
Чем отличается сильная диссоциация от слабой диссоциации?
Сильная диссоциация характеризуется тем, что практически все молекулы соединения расщепляются на ионы воды. В случае слабой диссоциации только небольшая часть молекул диссоциирует, образуя ионы.
Как определяется степень диссоциации вещества в растворе?
Степень диссоциации вещества в растворе определяется как отношение количества молекул, диссоциировавшихся на ионы, к общему количеству молекул вещества в растворе. Этот показатель позволяет оценить, насколько эффективно вещество диссоциирует в растворе.
Почему некоторые вещества диссоциируются полностью, а другие только частично?
Степень диссоциации вещества зависит от его химической структуры и силы связей между молекулами. Сильные электролиты, такие как соли, обычно диссоциируются полностью, в то время как слабые кислоты или основания диссоциируют только частично из-за слабости их ионных связей.



