Когда мы говорим о строении атомов, то невозможно не обратить внимание на роль энергетического уровня внешней оболочки электронов. Это как некий "адрес", куда электроны могут находиться, определяя свои движения и возможности. По своей сути эти уровни очень похожи на этажи многоэтажного здания. Каждый из них имеет свой набор комнат, в которых находятся электроны – незаменимые строительные элементы атомарной реальности.
Уровни энергии электронов в атоме определены определенным образом и их последовательность похожа на этажи здания, где каждая следующая комната является более высоким уровнем, чем предыдущая. Но в отличие от обычного строения, энергетические уровни атома не могут существовать без электронов. На каждом уровне может находиться определенное количество электронов, и их заполнение происходит в строгом соответствии с определенными правилами.
Такое распределение электронов по уровням не является произвольным, а на самом деле это суть закономерностей, правил и принципов, которых придерживаются электроны. Заполнение энергетических уровней происходит с учетом энергетической активности электронов и их взаимодействия с другими электронами и ядрами атома.
Внешний энергетический уровень атома: общая характеристика

При изучении строения атомов важную роль играет внешний энергетический уровень. Этот уровень представляет собой внешнюю оболочку, в которой находятся электроны. Взаимодействие атомов, формирование химических связей и химические реакции зависят от состояния этого внешнего уровня.
Внешний энергетический уровень атома можно представить как энергетический околоядренный порог, который характеризуется определенными свойствами и особенностями. Он обладает определенной энергией, определяющей положение атома внутри периодической системы элементов. Также на этом уровне находятся внешние электроны, отвечающие за химические взаимодействия и формирование химических связей.
- Внешний энергетический уровень определяет химические свойства атома.
- Количество электронов на внешнем энергетическом уровне определяет валентность атома.
- По состоянию внешнего энергетического уровня можно определить активность атома в химических реакциях.
- Внешний энергетический уровень имеет значительное значение при формировании сложных молекулярных соединений.
Изучение внешнего энергетического уровня атома позволяет понять его химическую природу, предсказать его химические свойства и взаимодействия с другими атомами. Это является важным шагом в понимании и применении химических процессов в различных областях науки и технологии.
Основные подходы к определению энергетического уровня, на котором находятся электроны около атомного ядра

Данная статья рассматривает главные принципы, которые позволяют определить расположение электронов в атоме на внешнем уровне энергии.
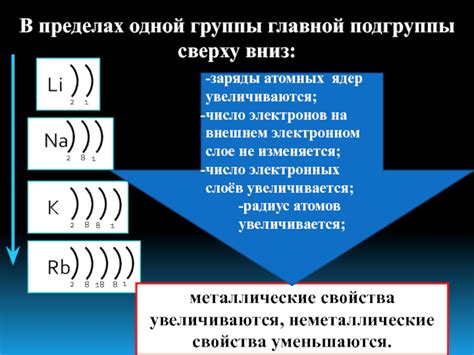
Одним из подходов является использование таблицы Менделеева, где элементы разделены по группам и периодам. Каждая группа представляет элементы с одинаковым числом электронов на внешнем энергетическом уровне. Например, элементы группы 1 имеют один электрон на внешнем уровне, в то время как элементы группы 18 имеют полностью заполненный внешний уровень энергии.
Другим подходом является использование правила абберрации, которое утверждает, что электроны заполняют энергетические уровни по порядку возрастания их энергии. Это означает, что на самом низшем энергетическом уровне располагается только два электрона, на следующем - до восьми, на третьем - до восемнадцати и так далее.
Также стоит упомянуть принципы заполнения внутренних энергетических уровней, которые могут влиять на расположение электронов на внешнем уровне. Например, принцип заполнения электронами s-подуровня происходит до заполнения d-подуровней и т.д.
| Подходы к определению энергетического уровня |
|---|
| Использование таблицы Менделеева |
| Правило абберрации |
| Принципы заполнения внутренних энергетических уровней |
Роль валентности атомов и связь с электронной структурой внешней оболочки

Взаимодействие вещества и реакции, которые происходят между атомами, основаны на их электронной структуре внешней оболочки. Вместе с тем, валентность атомов играет важную роль в процессах химической связи. В данном разделе мы рассмотрим связь между валентностью атомов и их электронной структурой внешней оболочки.
Валентность атома определяется количеством электронов на его внешнем энергетическом уровне, который является самым удаленным от ядра. Электроны на этом уровне называются валентными электронами. Их количество определяет, какой тип связи может образоваться между атомами, а также их возможности к образованию химических соединений и участию в химических реакциях.
Количество валентных электронов на внешнем энергетическом уровне может быть представлено в виде электронной формулы элемента. Эта формула указывает количество электронов в каждой оболочке атома и позволяет определить его валентность. Например, элемент с электронной формулой "2-8-1" будет иметь один валентный электрон на внешнем энергетическом уровне и валентность равную 1.
Валентность атома напрямую связана с его способностью образовывать химические связи. Атомы с небольшим количеством валентных электронов имеют тенденцию отдавать или принимать электроны, чтобы достичь стабильной конфигурации. Такие атомы проявляют большую активность в химических реакциях и образуют ионные соединения. В то же время, атомы с полностью заполненной внешней оболочкой имеют малую склонность к реакциям и образуют ковалентные соединения с соседними атомами.
Понимание валентности атомов и их связи с электронной структурой внешней оболочки играет важную роль в изучении реакций, создании новых веществ и улучшении различных технологических процессов. Надежное знание этих принципов позволяет установить паттерны и предсказать свойства веществ, что является важным инструментом для химиков и исследователей.
Роль электронной структуры в химических реакциях

Взаимодействие электронов на внешнем энергетическом уровне имеет критическое значение в процессе химических реакций. Уникальная конфигурация электронов на этом уровне определяет свойства вещества и способствует формированию соединений с другими элементами. Различные энергетические уровни внешних электронов синхронизируют свою активность и ведут себя как основные игроки в химических процессах.
Определенная электронная конфигурация внешнего уровня определяет способность атома образовывать связи с другими атомами. В этом процессе электроны играют роль ключа, который открывает или закрывает двери для образования химических соединений.
Важно отметить, что изменение электронной структуры на внешнем уровне может привести к существенным изменениям в свойствах элемента и его способности взаимодействовать с другими веществами. Такие изменения могут быть основой для получения новых материалов, разработки лекарственных препаратов и создания эффективных катализаторов.
Исторические исследования показывают, что элементы с схожей электронной структурой на внешнем уровне обладают схожими химическими свойствами и степенью реакционной активности. Например, элементы одной группы периодической системы имеют одинаковое количество электронов на внешнем энергетическом уровне и, соответственно, обладают схожими химическими свойствами. Это позволяет классифицировать элементы и предсказывать их реакционную активность в определенных условиях.
Таким образом, понимание значения электронной конфигурации на внешнем энергетическом уровне является ключевым для объяснения химических реакций и обусловливает разнообразие свойств и возможностей различных веществ в мире химии.
Изменение расположения электронов на внешнем энергетическом уровне при получении ионов
При образовании ионов происходят значительные изменения в расположении электронов на внешнем энергетическом уровне атома. Эти изменения ведут к образованию ионов с положительным или отрицательным зарядом.
Атомы могут приобретать или терять электроны, чтобы достичь более стабильной электронной конфигурации. При получении дополнительных электронов атомы становятся отрицательно заряженными ионами, называемыми анионами. Эти ионы образуются, когда атомы из групп элементов переносят одну или несколько электронов на внешний энергетический уровень.
С другой стороны, атомы могут потерять электроны и стать положительно заряженными ионами, называемыми катионами. Чтобы достичь более стабильной электронной конфигурации, атомы из элементов основной группы отдают одно или несколько электронов со своего внешнего энергетического уровня.
Изменение электронной конфигурации внешнего энергетического уровня при образовании ионов является ключевым аспектом химических реакций и взаимодействия элементов. Это также играет важную роль в формировании свойств веществ и их способности образовывать соединения.
Вопрос-ответ

Какие основные принципы определяют электронную конфигурацию внешнего энергетического уровня?
Основными принципами, определяющими электронную конфигурацию внешнего энергетического уровня, являются принцип заполнения, принцип Паули и принцип Хунда. Принцип заполнения гласит, что электроны заполняют энергетические уровни в порядке возрастания их энергии. Принцип Паули устанавливает, что каждый электрон в атоме должен обладать уникальными квантовыми числами, включая спин. Принцип Хунда гласит, что при заполнении подуровней с одинаковыми энергиями электроны заполняют их таким образом, чтобы число парных спинов было максимальным.
Какое значение имеет электронная конфигурация внешнего энергетического уровня?
Электронная конфигурация внешнего энергетического уровня определяет свойства атома и его химическую активность. Зная конфигурацию внешнего энергетического уровня, можно предсказать, как атом будет взаимодействовать с другими атомами и молекулами и какие соединения он может образовывать. Конфигурация внешнего энергетического уровня также влияет на энергию и структуру атома.
Какой алгоритм используется для определения электронной конфигурации внешнего энергетического уровня?
Определение электронной конфигурации внешнего энергетического уровня происходит по следующему алгоритму. Сначала находим атомный номер элемента в таблице Mendeleev. Затем определяем число электронов, соответствующее атомному номеру элемента. Далее распределяем электроны по энергетическим уровням и подуровням согласно принципам заполнения, Паули и Хунда.
Какие особенности имеет электронная конфигурация внешнего энергетического уровня у инертных газов?
У инертных газов на внешнем энергетическом уровне обычно находится полностью заполненный s- или p-подуровень. Это делает эти газы стабильными и некими "химически недвижимыми", то есть, они не образуют химических соединений с другими элементами. Наличие полностью заполненной последней оболочки сделало эти элементы инертными и неактивными.
Каково значение электронной конфигурации внешнего энергетического уровня?
Электронная конфигурация внешнего энергетического уровня определяет химические свойства атомов и их способность образовывать химические связи. Внешний энергетический уровень содержит валентные электроны, которые участвуют в химических реакциях и образовании химических связей с другими атомами. Таким образом, электронная конфигурация внешнего энергетического уровня играет важную роль в объяснении химической активности и химической реакционной способности атомов.
Какие принципы лежат в основе электронной конфигурации внешнего энергетического уровня?
Основные принципы электронной конфигурации внешнего энергетического уровня включают правило заполнения подуровней (правило Хунда), правило Паули и правило обитания валентных электронов в доступных энергетических уровнях атома. Согласно правилу Хунда, электроны заполняют подуровни с одиночными спинами, прежде чем заполнять подуровни с парными спинами. Правило Паули утверждает, что в подуровне могут находиться максимум два электрона с противоположным спином. Кроме того, электроны будут занимать доступные энергетические уровни наиболее близкие к ядру атома.



