Энергия активации (Эн) - важное понятие в химии, которое отражает энергетический барьер для протекания химических реакций. Она представляет собой минимальную энергию, необходимую для начала реакции и преодоления активации. Энергия активации определяет скорость химических процессов и их эффективность.
Свойства энергии активации: Энергия активации зависит от конкретной химической реакции и характеризует ее сложность. Если активация требует большой энергии, реакция идет медленно, а если энергия активации невелика, то реакция протекает быстро.
Применение энергии активации в химии: Понимание энергии активации позволяет оптимизировать процессы химических реакций, управлять кинетикой реакций и повысить их эффективность. Изучение данного понятия является важным для понимания химических процессов и разработки новых методов синтеза в химии.
Энергия активации: определение, значение, роль

Значение энергии активации заключается в том, что она определяет скорость химической реакции. Чем меньше энергия активации, тем быстрее протекает реакция, и наоборот. Поднятие или понижение этой энергии может ускорить или замедлить химическую реакцию.
Роль энергии активации в химических реакциях заключается в том, что она обеспечивает доступ к переходному состоянию, когда реагенты начинают превращаться в продукты. Без энергии активации химические реакции могли бы быть фактически невозможными или проходили бы слишком медленно.
Сущность энергии активации в химии

Энергия активации можно рассматривать как барьер, который необходимо преодолеть, чтобы реакция могла протекать. Чем выше энергия активации, тем медленнее происходит реакция. Понимание этой концепции позволяет оптимизировать условия проведения химических реакций.
Изучение энергии активации позволяет предсказывать, какие реакции будут более вероятными и эффективными. Понимание этой химической величины позволяет ученым разрабатывать новые методы синтеза соединений и улучшать существующие химические процессы.
Энергия активации: связь с кинетикой реакций
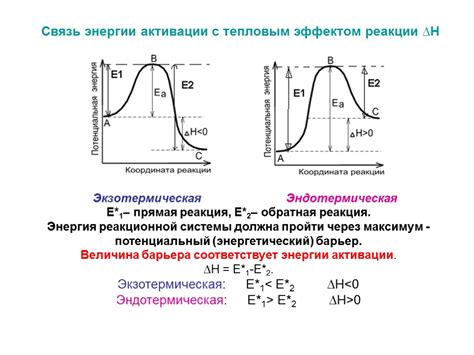
Энергия активации играет важную роль в кинетике химических реакций. Она представляет собой минимальную энергию, которую необходимо затратить для того, чтобы реакция начала протекать. Увеличение энергии активации приводит к замедлению скорости реакции, в то время как ее снижение ускоряет процесс. Энергия активации зависит от температуры и концентрации реагентов. Понимание этого параметра позволяет оптимизировать условия реакции и повысить ее эффективность.
Свойства энергии активации в химических реакциях
- Зависимость от температуры: с увеличением температуры энергия активации снижается, что приводит к ускорению реакции.
- Энергия активации может быть влияна катализаторами, которые снижают энергию активации и ускоряют реакцию.
- Энергия активации определяет скорость реакций: чем ниже энергия активации, тем быстрее происходит реакция.
Энергия активации: влияние на скорость процессов

Энергия активации играет ключевую роль в определении скорости химических реакций. Энергия активации представляет собой минимальную энергию, необходимую для того чтобы начать реакцию. Чем ниже энергия активации, тем быстрее происходит процесс.
Уменьшение энергии активации может быть достигнуто различными способами, например, добавлением катализаторов. Катализаторы снижают энергию активации, ускоряя реакцию без изменения конечных продуктов.
| Понятие | Энергия активации | Скорость реакции |
|---|---|---|
| Высокая | Требуется большая энергия для начала реакции | Реакция протекает медленно |
| Низкая | Требуется меньшая энергия для начала реакции | Реакция протекает быстро |
Участие энергии активации в химических превращениях

Как правило, энергия активации связана с тепловым движением частиц, что обуславливает необходимость нагрева среды или внесения катализатора для активации реакции. Катализаторы снижают энергию активации, ускоряя химические превращения и экономя энергию, которая в противном случае была бы затрачена на нагревание среды.
| Преимущества участия энергии активации: | Недостатки участия энергии активации: |
| Ускорение химических реакций | Необходимость в внешнем источнике энергии |
| Экономия энергии при использовании катализатора | Возможные изменения свойств среды |
Энергия активации: методы измерения и расчет

Существует несколько методов измерения энергии активации, включая:
- Методы кинетического анализа, основанные на изучении скорости реакции при различных температурах.
- Использование уравнения Аррениуса для расчета энергии активации по экспериментальным данным.
- Измерение теплоемкости системы при разных температурах и дальнейший анализ кинетических параметров.
Адекватное определение энергии активации позволяет предсказать температурные зависимости химических процессов и понять физико-химические механизмы реакций в различных системах.
Определение энергии активации экспериментальными методами
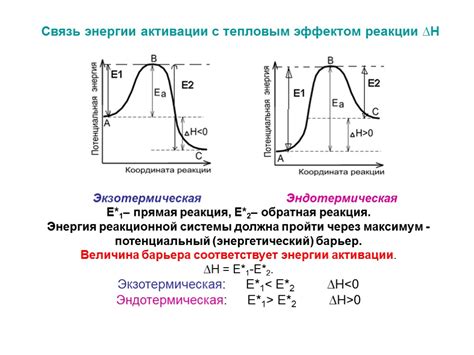
Метод ВАХ: одним из наиболее распространенных методов определения энергии активации является анализ изменения скорости реакции в зависимости от температуры. Путем построения графика зависимости ln(k) от 1/T можно определить энергию активации.
Метод Аррениуса: основанный на уравнении Аррениуса, который описывает зависимость температурной зависимости скорости реакции. Путем экстрополяции экспериментальных данных на графике ln(k) от 1/T можно определить энергию активации.
Использование этих и других экспериментальных методов позволяет определить энергию активации реакции с высокой точностью и важно для понимания механизма химических процессов.
Энергия активации: практическое применение

Катализаторы: Использование катализаторов позволяет снизить энергию активации химической реакции, ускоряя процесс и снижая затраты на энергию.
Пример: Катализаторы в промышленности применяются для ускорения процессов синтеза и снижения температуры, необходимой для проведения реакции.
Термоядерный синтез: В термоядерной реакции энергия активации высока, но при достижении определенных условий, например, высоких температур и давления, происходит реакция с высвобождением огромного количества энергии.
Пример: Процессы термоядерного синтеза применяются в ядерной энергетике для получения энергии.
Вопрос-ответ

Что такое эн аш 3 в химии?
Эн аш 3, или алюминий оксид (Al2O3), является химическим соединением, состоящим из алюминия и кислорода. Этот порошкообразный материал обладает высокой термической стабильностью, твердостью и инертностью, что делает его широко используемым в различных областях промышленности.
Какие свойства характеризуют эн аш 3?
Эн аш 3 обладает рядом уникальных свойств, таких как высокая термическая стабильность, химическая инертность, высокая твердость и теплопроводность. Это делает его отличным материалом для использования в производстве керамики, абразивов, литья металлов и других областях.