Аммиак (NH3) – это один из простейших аминов, который играет важную роль в химии и биохимии. Его молекула состоит из азота, к которому присоединены три водородных атома. Аммиак обладает свойством образовывать водородные связи между своими атомами, что влияет на его химические и физические свойства.
Водородная связь – это слабое притяжение между атомами водорода и электроотрицательными атомами (например, кислородом, азотом или фтором). В молекуле аммиака электронный запас азота делится между тремя водородными атомами, что приводит к образованию водородной связи между азотом и одним из водородов.
Наличие водородных связей в молекуле аммиака влияет на его протолитические свойства, способность к образованию комплексов с другими веществами, а также на формирование его структуры в кристаллическом состоянии. Понимание водородных связей в аммиаке имеет важное значение для понимания химических процессов, в которых он участвует.
Структура молекулы аммиака
Молекула аммиака (NH3) представляет собой трёхатомный соединение азота и водорода. В молекуле аммиака азот атом формирует три валентные связи с атомами водорода, образуя тетраэдрическую структуру.
| Атом | Число валентных электронов |
|---|---|
| Азот (N) | 5 |
| Водород (H) | 1 |
В молекуле аммиака азотный атом имеет один несвязанный электроновый пар, что делает его базичным и способным образовывать водородные связи с другими молекулами или ионами.
Расположение атомов
В молекуле аммиака (NH3) атомы азота и водорода соединены в виде треугольной плоскости. Атом азота находится в центре молекулы, а три атома водорода равномерно распределены вокруг него. Каждый атом водорода образует одну водородную связь с азотом, что обеспечивает устойчивую структуру молекулы аммиака.
Наличие азота в молекуле аммиака
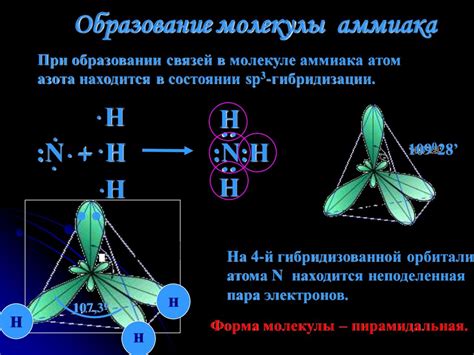
Молекула аммиака (NH3) состоит из трех атомов водорода и одного атома азота. Азот в молекуле аммиака обладает четырьмя электронами в внешней оболочке, что позволяет ему образовывать три водородных связи с атомами водорода. Таким образом, азот играет важную роль в структуре аммиака, обеспечивая его химические свойства.
Свойства аммиака

1. Физические свойства:
Аммиак – газ с характерным едким запахом, обладает живительной силой. При комнатной температуре аммиак легколетуч и растворим в воде.
2. Химические свойства:
Аммиак является крепкой основой и способен образовывать соли, образует аммоний с различными кислотами. Также он образует водородные связи, что делает его важным соединением в химических реакциях и в биологических процессах.
Формирование водородных связей
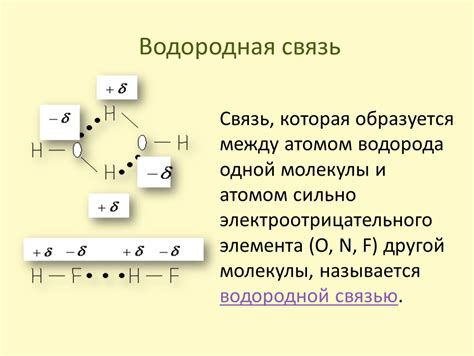
Водородные связи возникают в молекуле аммиака (NH3) за счет взаимодействия водородных атомов с свободными электронными парами атома азота. Атом азота имеет один пар электронов, который может образовывать взаимодействия с водородными атомами. Каждый водородный атом образует водородную связь с азотом, что обеспечивает устойчивость молекулы аммиака.
Водородные связи характеризуются как относительно слабые взаимодействия по сравнению с ковалентными связями, но играют важную роль в стабилизации структуры молекулы аммиака. Эти взаимодействия также способствуют образованию межмолекулярных водородных связей, что может оказывать влияние на физические свойства аммиака.
Влияние электронной структуры на наличие водородных связей в молекуле аммиака
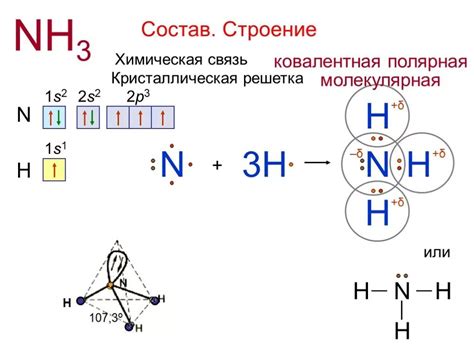
Электронная структура молекулы аммиака NH₃ влияет на возможность образования водородных связей. Аммиак содержит один атом азота и три атома водорода. Азот обладает электронной конфигурацией 1s²2s²2p³ и имеет один незанятый электронный орбитальный парамагнитный несовершенство. Этот незанятый p-орбитальный электрон обладает силой аддукции к атомам водорода, образуя водородные связи.
Водородные связи в молекуле аммиака играют важную роль в молекулярной структуре и свойствах вещества. Благодаря наличию водородных связей аммиак обладает повышенной полюсностью, что приводит к образованию межмолекулярных и внутримолекулярных взаимодействий и влияет на его физические и химические свойства.
Пример водородных связей в аммиаке
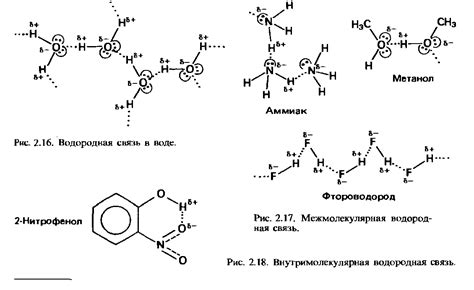
В молекуле аммиака (NH3) кислород атома одной молекулы образует две водородные связи с водородными атомами других молекул аммиака, образуя водородные мостики. Это приводит к образованию трех изогнутых линий, которые представляют собой водородные связи между молекулами аммиака.
Энергия водородной связи

Энергия водородной связи в молекуле аммиака способствует ее устойчивости и влияет на различные физико-химические свойства данного соединения. Изучение энергии водородной связи позволяет лучше понять характер взаимодействия в молекулах и их устойчивость при различных условиях.
Использование информации об аммиаке
| Применение информации об аммиаке | Описание |
|---|---|
| Производство удобрений | Аммиак используется как сырье для производства азотных удобрений, что способствует повышению урожайности сельскохозяйственных культур. |
| Химическая промышленность | Аммиак применяется в производстве различных химических веществ, таких как азотные кислоты, амиды и другие соединения. |
| Анализ водных растворов | Знание о водородных связях в молекуле аммиака помогает при анализе водных растворов и взаимодействии аммиака с другими молекулами. |
Роль водородных связей в химии
Водородные связи играют важную роль в химии, обусловливая множество химических и физических свойств веществ. Эти связи возникают между атомами водорода и другими атомами, такими как кислород, азот или фтор.
Водородные связи обеспечивают стабильность молекул и межмолекулярных взаимодействий, таких как водородные связи между молекулами воды или аммиака. Они влияют на физические свойства веществ, такие как температура кипения и плавления, вязкость и растворимость.
Благодаря водородным связям возможно образование стабильных трехмерных структур, таких как спиральные двуспиральные геликсы в ДНК и белках.
Таким образом, водородные связи играют важную роль в химических процессах и обуславливают множество особенностей молекул и веществ, делая их уникальными и разнообразными.
Вопрос-ответ

Какие атомы в молекуле аммиака участвуют в образовании водородных связей?
В молекуле аммиака (NH3) водородные связи образуются между атомом азота (N) и водородными атомами (H). Таким образом, атом азота участвует в формировании водородных связей.
Как наличие водородных связей в молекуле аммиака влияет на его свойства?
Водородные связи в молекуле аммиака обеспечивают ее устойчивость и способность образовывать водородные связи с другими молекулами. Это может повлиять на свойства аммиака, такие как его кипящую точку, растворимость и молекулярную структуру.



