В мире химии каждый элемент имеет свою уникальную молярную массу, которая играет ключевую роль во множестве химических расчетов и реакций. Знание молярной массы элемента позволяет определить количество вещества или массу, необходимую для достижения желаемого результата. Однако как установить молярную массу элемента без использования сложных формул и вычислений? Это возможно благодаря таблице элементов, на которой отображается не только символ и номер элемента, но и его атомная масса.
Таблица элементов является незаменимым инструментом для химиков всех уровней и опыта. В ней представлено множество полезной информации о каждом химическом элементе, начиная от его имени и символа, заканчивая массовым числом и электронной конфигурацией. Но для определения молярной массы необходимо обратить внимание на атомную массу элемента, которая указывается в таблице.
Атомная масса элемента – это масса атома данного элемента в атомных единицах. Она определяется на основании среднего арифметического масс всех его изотопов с учетом их относительной распространенности в природе. Атомная масса указывается рядом с символом элемента и представляет собой число с десятичным разделителем. Таким образом, благодаря таблице элементов, можно легко и быстро найти атомные массы всех необходимых элементов и использовать их для расчета молярной массы соединений и веществ.
Описание молярной массы химического элемента

Молярная масса элемента - это значение, показывающее, сколько граммов вещества содержится в одном моле данного элемента. Она определяется путем сравнения массы данного элемента с массой одного моля водорода, которая равна приблизительно 1 грамму.
Молярная масса элемента важна для решения различных химических задач, таких как расчеты состава реакционных смесей, определение степени чистоты вещества или анализ соединений. Она также позволяет сравнивать массы различных элементов и прогнозировать их поведение в химических реакциях.
Знание молярной массы элемента позволяет более глубоко понять его свойства и взаимодействия с другими элементами. Это фундаментальное понятие, которое является основой для изучения химии и позволяет ученым создавать новые вещества и материалы с заданными свойствами.
Определение сущности и ее значимости в химии

Сущность – это совокупность атомов, ионов или молекул, объединенных определенными принципами, обладающих характеристическими физическими и химическими свойствами. В контексте химии, сущность является базовой единицей изучения веществ и играет важную роль в определении и предсказании их свойств и реакций.
Значимость этого понятия не может быть недооценена, поскольку понимание сущности вещества позволяет химикам раскрыть его структуру, определить его характеристики и установить взаимосвязи с другими веществами.
При изучении сущности вещества, химики также обращают внимание на еще один важный параметр - массу. Масса – это количественная характеристика сущности, которая выражается числовыми значениями и измеряется в граммах или в иных единицах измерения. Определение массы является неотъемлемой частью изучения химических веществ, и обладание точными значениями массы позволяет проводить различные рассчеты и определения в химических экспериментах.
Таким образом, понимание понятия сущности и значимость массы в химии является важной составляющей для понимания основ химических процессов и позволяет исследователям точно определять свойства и взаимодействия веществ.
Узнавайте массу атомов с помощью таблицы химических элементов
Таблица химических элементов предоставляет информацию о всех известных элементах и их основных свойствах, включая атомные массы. Атомный вес элемента указывается в таблице как число, расположенное под его символом. Это число отражает среднюю массу атомов данного элемента, учитывая их различные изотопы и их относительное распределение в природе.
| Символ элемента | Атомный вес |
|---|---|
| H | 1.008 |
| He | 4.0026 |
| Li | 6.94 |
| Be | 9.0122 |
| B | 10.81 |
Для узнавания атомного веса элемента необходимо найти его символ в таблице химических элементов и обратить внимание на указанное значение атомного веса. Например, атомный вес водорода (H) равен 1.008.
Зная атомный вес элемента, можно легко определить его молярную массу и использовать эту информацию в различных химических расчетах. Какое бы вещество вы ни изучали, таблица химических элементов будет вашим надежным инструментом для определения атомного веса и других химических характеристик элементов.
Использование химической таблицы и массы атомов в изучении химических элементов
Молярная масса - это величина, которая выражает массу одного моля вещества. Она является фундаментальным понятием в химии, так как позволяет измерять количество вещества, используя массу. Молярная масса каждого элемента указывается в таблице химических элементов наряду с другими характеристиками.
Использование таблицы элементов и молярной массы важно для понимания физических и химических свойств элементов и их соединений. Молярная масса позволяет определить массу одного моля вещества и использовать эту информацию при расчетах, связанных с количеством вещества или реакционной способностью элемента. Кроме того, зная молярную массу, можно определить количество вещества, массу или объем, связанные с определенным количеством элемента.
Количество атомов вещества и его связь с молярной массой
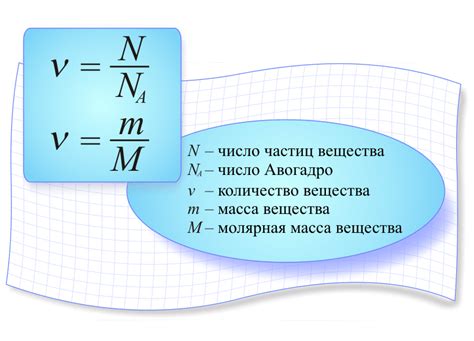
Для полного понимания химических реакций и состава вещества необходимо иметь представление о количестве атомов, которые присутствуют в данном веществе. Количество атомов вещества, также известное как количество вещества, можно определить на основе его молярной массы и других связанных понятий.
Молярная масса - это масса одного моля вещества, выраженная в единицах массы, таких как грамм. Она является средством для определения качественного и количественного состава вещества. Для определения количества атомов вещества необходимо знать его молярную массу и использовать эмпирические формулы, такие как формула Стейнера или число Авогадро.
- Формула Стейнера - это математическая формула, позволяющая связать количество вещества, массу вещества и молярную массу. Она выражается следующим образом: количество вещества = масса вещества / молярная масса.
- Число Авогадро - это числовая константа, равная количеству атомов, молекул или ионов в одном моле вещества. Она равна приблизительно 6,022 × 10^23.
Используя данные о молярной массе и применяя формулу Стейнера или число Авогадро, можно определить количество атомов вещества. Это позволяет установить отношение количества вещества к другим химическим величинам, таким как объем, концентрация и количество реагентов, необходимых для проведения химических реакций. Знание количества атомов вещества является важным для проведения химических расчетов и понимания основ химических превращений.
Вычисление количества молей по атомной массе и молекулярной формуле

В данном разделе рассматривается методика вычисления количества молей вещества на основе известного атомного веса и молекулярной формулы. Этот подход позволяет определить количество вещества, независимо от применения таблицы элементов или других методов определения молярной массы. Имея эти данные, можно уточнить количество атомов в молекуле и провести различные вычисления.
Основным инструментом для вычисления количества молей является атомный вес. Атомный вес – это масса одного атома химического элемента, выраженная в атомных единицах. Его можно найти в таблице элементов или, при необходимости, поставив экспериментальные данные. Атомный вес представляет собой отношение массы одного атома к одной двенадцатой массе атома углерода-12.
Молекулярная формула является ключевым элементом в вычислении количества молей. Она показывает правильное количество каждого атома в молекуле вещества. Молекулярная формула может быть простой, например, H2O для воды, или сложной, такой как C6H12O6 для глюкозы. Зная молекулярную формулу, можно определить количество каждого атома в составе молекулы.
После нахождения атомного веса и молекулярной формулы можно легко вычислить количество молей. Сначала необходимо разложить молекулярную формулу на составляющие атомы и их количества. Затем умножьте количество каждого атома по их атомному весу. И, наконец, сложите получившиеся значения, чтобы найти общее количество молей вещества.
- Шаг 1: Получите атомный вес каждого атома из таблицы элементов
- Шаг 2: Разложите молекулярную формулу на атомы и их количество
- Шаг 3: Умножьте количество каждого атома на его атомный вес
- Шаг 4: Сложите полученные значения, чтобы найти общее количество молей вещества
Исследование молярной массы ионов: ключ к пониманию химических реакций

Для определения молярной массы ионов требуется ориентироваться на таблицу химических элементов, где приведены данные о массе каждого из них. Но как же использовать эту информацию?
Во-первых, необходимо понимать, что ион состоит из атомов, каждому из которых присуща своя молярная масса. Следовательно, молярная масса иона будет зависеть от числа атомов, образующих данный ион.
Следующий важный шаг - определение заряда иона. Ион может быть положительно или отрицательно заряженным. Зная заряд иона, мы можем использовать таблицу химических элементов, чтобы определить массу одного атома данного элемента.
Зная массу одного атома ионизирующего элемента и число его атомов в ионе, мы можем умножить эти значения и получить молярную массу иона.
Итак, понимание процесса определения молярной массы ионов является важным шагом в понимании различных аспектов химических реакций. Теперь, имея этот инструмент, вы сможете лучше интерпретировать молекулярные формулы, участвовать в более сложных расчетах и расширить свои навыки химического анализа.
Применение таблицы элементов и заряда иона
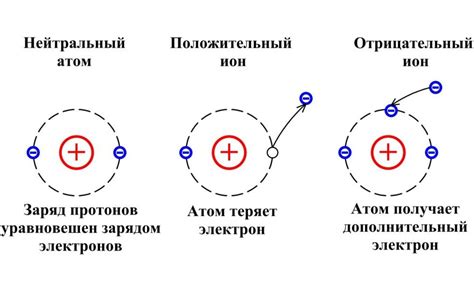
В данном разделе мы рассмотрим использование таблицы элементов и заряда иона в химических расчетах и определении свойств веществ. Наличие сведений о химических элементах и их свойствах, представленных в таблице элементов Периодической системы, позволяет систематизировать и анализировать информацию, что облегчает и улучшает процесс исследования и понимания химических явлений.
Таблица элементов характеризуется наличием разнообразных параметров, таких как атомный номер, символ элемента, атомная масса и заряд ядра. Заряд ионов, возникающих при образовании химических соединений, играет ключевую роль в определении их химических свойств и взаимодействий. От заряда иона зависит его способность к образованию соединений, реактивность и прочие характеристики, которые важны при проведении химических расчетов.
Применение таблицы элементов и заряда иона позволяет определить степень окисления элемента в химическом соединении, что особенно ценно при составлении уравнений реакций и проведении расчетов по химическим формулам. Наличие информации о зарядах ионов также помогает в определении состава и строении химических соединений, а также в их классификации.
Расчет массы сложного соединения по химической формуле

Вместо того, чтобы просто сложить массы всех атомов в соединении, необходимо учитывать их количество в молекуле. Для этого можно использовать химическую формулу соединения, в которой каждый элемент указан соответствующим обозначением и индексом.
Сначала нужно найти массу каждого отдельного элемента в таблице элементов и умножить ее на соответствующий индекс в формуле. Затем все полученные значения суммируются, чтобы получить молярную массу сложного соединения.
| Элемент | Обозначение | Масса (г/моль) | Индекс в формуле | Масса элемента в соединении (г/моль) |
|---|---|---|---|---|
| Кислород | O | 16 | 3 | 48 |
| Водород | H | 1 | 4 | 4 |
| Углерод | C | 12 | 6 | 72 |
| Азот | N | 14 | 2 | 28 |
Например, для сложного соединения CH3COOH (уксусная кислота) можно определить молярную массу, учитывая массы каждого элемента и их количество в формуле. В данном случае, масса углерода (C) равна 12 г/моль, масса водорода (H) - 1 г/моль, а масса кислорода (O) - 16 г/моль. Умножив эти значения на соответствующие индексы в формуле (1, 3, 2), получим массы элементов в соединении: углерод (12 г/моль * 1 = 12 г/моль), водород (1 г/моль * 3 = 3 г/моль), кислород (16 г/моль * 2 = 32 г/моль). Суммируя эти значения, получим молярную массу соединения CH3COOH равную 47 г/моль.
Суммирование масс атомов в формуле соединения

Работая с молярными массами отдельных элементов, можно определить молярную массу соединения путем сложения масс атомов, входящих в его формулу. Это важный шаг при расчетах в химии, позволяющий получить информацию о массовом составе соединений.
Применение молярной массы в решении химических задач

Основное применение молярной массы заключается в расчетах стехиометрических соотношений. С помощью молярной массы мы можем определить количество вещества, которое формируется или требуется на протяжении химической реакции. Также, зная молярную массу, мы можем вычислить массу вещества, зная его количество в молях. Молярная масса также позволяет проводить сравнительные анализы различных веществ и соединений, определять их процентное содержание в смесях и растворах, а также рассчитывать процентные выходы химических реакций.
- Расчет массы вещества
- Расчет объема газа
- Расчет числа молекул
- Расчет стехиометрических соотношений
- Определение процентного содержания
- Концентрация растворов
- Формула соединения на основе молекулярной массы
- Анализ физических и химических свойств
Умение использовать молярную массу в решении химических задач позволяет химикам и студентам химических специальностей успешно проводить исследования, качественный и количественный анализ веществ, а также прогнозировать реакции и свойства химических соединений.
Примеры расчетов с использованием молярной массы элементов

В данном разделе мы рассмотрим несколько интересных примеров, демонстрирующих применение понятия молярной массы элементов.
Первый пример связан с расчетом массовых долей элементов в химических соединениях. Если известна химическая формула соединения, то с помощью молярной массы его компонентов можно определить, сколько грамм каждого элемента содержится в данном соединении. Это особенно полезно для составления химических уравнений и прогнозирования химических реакций.
Далее рассмотрим пример использования молярной массы для расчета количества вещества. Зная массу вещества в граммах и его молярную массу, можно определить количество молей этого вещества. Эта информация может быть важна при проведении химических экспериментов, анализе проб или при решении химических задач.
Третий пример связан с расчетом объема газов. Используя молярную массу газа и его плотность, можно определить массу газа в единицах объема. Зная массу газа и его молярную массу, можно определить объем газа. Данные расчеты могут быть полезными при работе с газовыми смесями или при проведении определенных химических реакций.
- Расчет массовых долей элементов в химических соединениях.
- Расчет количества вещества на основе молярной массы.
- Расчет объема газов с использованием молярной массы.
Вопрос-ответ

Какие данные нужны для определения молярной массы по таблице элементов?
Для определения молярной массы по таблице элементов необходимо знать атомные массы каждого элемента в соединении и их количества. Эта информация может быть получена из химической формулы вещества.
Как используется таблица элементов при определении молярной массы?
Для определения молярной массы по таблице элементов, нужно умножить атомные массы каждого элемента в соединении на их количество, а затем сложить полученные произведения. Таким образом, можно получить общую массу всех атомов в одной молекуле или формуле вещества.
Можно ли использовать средние значения атомных масс из таблицы элементов?
Да, можно использовать средние значения атомных масс при определении молярной массы. Средние значения указаны в таблице элементов и учитывают все изотопы элемента, а также их процентное содержание на Земле. Однако, для точности расчетов, иногда требуется использовать точную атомную массу.
Можно ли определить молярную массу сложных химических соединений?
Да, можно определить молярную массу сложных химических соединений, используя таблицу элементов. Необходимо знать химическую формулу такого соединения и провести расчет, умножая атомные массы каждого элемента на их количество, а затем сложить все полученные произведения.
Какая единица измерения используется для молярной массы?
Молярная масса измеряется в граммах на моль (г/моль). Эта единица позволяет выразить массу одной молекулы или формулы вещества в граммах. Она является важным понятием в химии для расчетов количества вещества и реакций.



