В бесконечном лабиринте химических реакций существуют встречи, способные удивить своими непредсказуемыми последствиями. Одна из таких встреч нередко приводит к сенсационным результатам и волнующим открытиям. В самом сердце этой мистической стычки находится реакция, что распаляет страсти ученых и покоряет своей грандиозностью.
Рассмотрим радикально привлекательную комбинацию веществ, в которой замысловато соединяются изрядное количество элементов. Этот фантастический шедевр вызывает стремление раскрыть тайну и научиться манипулировать процессом. Однако, для того чтобы полностью понять эту высокоинтеллектуальную эпопею, необходимо детальнее разобраться в каждом из компонентов и их уникальных ролей при взаимодействии.
Открывая двери в химическую лабораторию, можно представить себе этот хаотический водоворот, где миллионы ионов и молекул сходятся, образуя поразительные цепочки превращений. И только осмотрительные глаза опытных ученых могут заметить даже мельчайшие детали этого изумительного процесса, что становится основой для последующих открытий и откровений.
Взаимодействие уникального соединения с универсальной кислотой: важность и результаты

Одно из наиболее интересных и сложных химических взаимодействий представляет собой соединение, образующееся при слиянии уникального соединения с влиятельной и широко применяемой универсальной кислотой. При этом происходит феноменальная трансформация соединений, сочетающаяся с высвобождением энергии и образованием разнообразных продуктов.
Цель данного раздела - детальное описание фундаментального процесса, происходящего между указанными соединениями, с учетом особенностей и трудностей его исследования. Мы рассмотрим процесс разрушения уникальности соединения под воздействием разъедающей силы универсальной кислоты и затем уделим внимание образованию новых веществ, получающихся в результате реакции.
В ходе экспериментов было обнаружено, что изначально стабильное и непроницаемое соединение сталкивается с сильными электростатическими силами соляной кислоты, вызывая разрушение его структуры и приводя к высвобождению дополнительной энергии. Это происходит вследствие процессов ионизации и диссоциации соединений, где активная природа универсальной кислоты играет ключевую роль.
В результате такого разрушительного взаимодействия, к новым веществам, обладающим различными свойствами, относятся продукты, образованные в результате реакции. Данные продукты представляют собой переменные соединения, которые, в свою очередь, могут использоваться во многих областях науки, техники и промышленности.
В заключении, понимание механизма и особенностей реакции между уникальным соединением и соляной кислотой является отличной отправной точкой для дальнейших исследований в области химии, а также может привести к разработке новых методов синтеза и применения веществ с широкими практическими возможностями.
Процесс протекает при взаимодействии двух веществ, обладающих особыми свойствами

В данном разделе представлен подробный анализ механизма процесса, происходящего при столкновении двух веществ, имеющих уникальные свойства. Это весьма интересный процесс, включающий в себя такие составляющие как взаимодействие, образование и обмен энергии. В результате этой реакции происходит образование новых соединений и перераспределение энергии. Важно отметить, что данный процесс имеет специфические особенности, которые подробно рассмотрены в других разделах.
Химические свойства карбоната кальция

Исследование химических свойств карбоната кальция позволяет раскрыть его уникальные характеристики и влияние на различные процессы. Многообразие реакций и взаимодействий, которые может претерпевать карбонат кальция, делает его одним из самых интересных соединений в химии.
Стойкость соединения: Карбонат кальция обладает высокой стойкостью и устойчивостью к воздействию многих агрессивных веществ. Благодаря этому он широко применяется в различных областях - от строительства до медицины.
Реакции с кислотами: Одним из наиболее изученных свойств карбоната кальция является его взаимодействие с кислотами. При этом происходит выделение углекислого газа и образование соли. Карбонат кальция может реагировать со многими кислотами, при этом скорость реакции и ее характер могут различаться в зависимости от условий.
Растворимость: Карбонат кальция не растворяется в воде, однако он может растворяться при взаимодействии с некоторыми кислотами или другими соединениями. Это свойство позволяет использовать карбонат кальция в различных промышленных процессах, в том числе при нейтрализации кислотных растворов.
Формирование осадков: Карбонат кальция является основным компонентом при образовании некоторых природных осадков, таких как морские раковины и кораллы. За счет своей способности реагировать с углекислым газом из атмосферы, карбонат кальция играет важную роль в карбонатном цикле и стабилизации климата.
Влияние на окружающую среду: Большое количество карбоната кальция наблюдается в природных водах и почвах. Это свойство существенно влияет на их химический состав и реакционную способность. Карбонат кальция выполняет важные функции в природных экосистемах и в процессе формирования почвы.
Характеристики соляной кислоты

Соляная кислота, также известная как хлороводородная кислота, представляет собой одну из наиболее распространенных и важных неорганических кислот. Эта химическая соединение обладает рядом уникальных свойств и широко используется в различных отраслях науки и промышленности.
- Кислотные свойства: Соляная кислота обладает высокой кислотностью и способностью образовывать ион водорода (H+). Она легко взаимодействует с базами и проявляет реактивность в отношении металлов, оксидов, оснований и некоторых органических соединений.
- Высокая растворимость: Соляная кислота хорошо растворяется в воде, образуя насыщенный раствор с высокой концентрацией. Это свойство является важным при использовании данной кислоты в химической лаборатории и промышленности.
- Опасность: В чистом виде и даже в разбавленном состоянии соляная кислота является едким и ядовитым веществом, способным вызывать ожоги и другие повреждения кожи, слизистых оболочек и дыхательных путей. Поэтому необходимы особые меры предосторожности при работе с ней.
- Применение: Соляная кислота находит применение в различных отраслях промышленности, включая производство удобрений, пищевую промышленность, нефтегазовую промышленность, фармацевтическую и химическую промышленность. Она также используется в процессах очистки воды и осаждении металлов.
Образование и распады промежуточных соединений
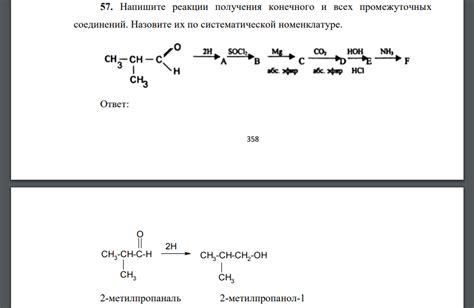
В данном разделе рассматривается процесс образования и последующие распады промежуточных соединений при взаимодействии соляной кислоты с карбонатом кальция. В процессе реакции возникают различные промежуточные соединения, которые играют важную роль в образовании конечных продуктов.
Первоначально, происходит взаимодействие карбоната кальция с соляной кислотой, в результате чего образуется одно из промежуточных соединений. Данное соединение, в свою очередь, может подвергаться распаду при определенных условиях, образуя другие промежуточные соединения или конечные продукты реакции.
Наиболее важными моментами являются условия, при которых происходит образование и распад промежуточных соединений. Факторы, такие как температура, концентрация соляной кислоты, реакционная среда, оказывают значительное влияние на данный процесс. Изменение этих параметров может приводить к образованию определенных соединений, а также изменению их стабильности и скорости распада.
Кроме того, важно обратить внимание на роль промежуточных соединений в контексте механизма реакции. Наличие этих соединений может указывать на специфические стадии процесса, а также дать представление о возможных промежуточных продуктах и путях образования конечных продуктов.
| Реакционные условия | Промежуточное соединение | Распад соединения |
|---|---|---|
| Высокая температура | Соединение А | Распад А в соединение В |
| Высокая концентрация кислоты | Соединение Б | Распад Б в соединение Г |
| Щелочная среда | Соединение В | Распад В в конечные продукты |
Практическое применение реакции в химической промышленности

Одним из практических применений этой реакции является производство алмазов. Используя разработанный механизм и особенности этой реакции, специалисты в области материаловедения смогли создать уникальный процесс синтеза алмазов. Проведение этой реакции в контролируемой среде позволяет получить идеально чистые алмазы с заданными физическими и химическими характеристиками.
Кроме производства алмазов, данная реакция также используется в фармацевтической промышленности. Благодаря ее особенностям и механизму, специалисты в области разработки лекарств могут получать определенные препараты с высокой степенью чистоты и активности. Это позволяет не только повысить эффективность лекарств, но и улучшить их безопасность при использовании.
| Практические применения | Промышленные отрасли |
|---|---|
| Синтез алмазов | Материаловедение |
| Производство фармацевтических препаратов | Фармацевтическая промышленность |
Вопрос-ответ

Каков механизм реакции карбоната кальция с соляной кислотой?
Реакция карбоната кальция (CaCO3) с соляной кислотой (HCl) происходит по следующему механизму: соляная кислота распадается на ионы водорода (H+) и ионы хлора (Cl-). Затем ионы водорода образуют воду (H2O) с ионами гидроксида (OH-) от щёлочного карбоната, образуя обильное пузырьков воды и подталкивая реакцию вперед. Таким образом, происходит растворение карбоната кальция, образуя раствор кальция (Ca2+) и ионы карбоната (CO32-).
Какова реакция исчезновения карбоната кальция после реакции с соляной кислотой?
Когда карбонат кальция реагирует с соляной кислотой, он полностью разлагается на ионы кальция и ионы карбоната. Таким образом, карбонат кальция исчезает, а вместо него образуется раствор кальция и ионы карбоната. Исчезновение карбоната кальция происходит из-за реакции с ионами водорода и хлора, образующихся в результате распада соляной кислоты.
Какие особенности можно выделить в реакции карбоната кальция с соляной кислотой?
Одной из особенностей реакции карбоната кальция с соляной кислотой является образование обильного количества пузырьков газа в результате реакции ионов водорода с ионами гидроксида. Также, при добавлении соляной кислоты к карбонату кальция можно наблюдать выделение углекислого газа, проведя простой эксперимент с индикатором. Кроме того, реакция является экзотермической, то есть сопровождается выделением тепла.
Можно ли использовать реакцию карбоната кальция с соляной кислотой в промышленности?
Реакция карбоната кальция с соляной кислотой может быть использована в промышленности для получения одного из проводников кальция. Кальций является важным элементом при производстве стали, а процесс получения кальция из карбоната кальция с использованием соляной кислоты может проводиться на промышленных масштабах. Однако, при использовании данной реакции необходимо учитывать безопасность и проводить ее под контролем специалистов.



