Орбиталь – это область пространства вокруг атомного ядра, где с наибольшей вероятностью можно найти электроны. В химии орбитали играют важную роль, поскольку они определяют строение атомов, молекул и химические связи.
В зависимости от формы и ориентации орбиталей их можно разделить на s-, p-, d- и f-орбитали. Каждая из них имеет свои собственные характеристики и способности к взаимодействию с другими орбиталями, что влияет на химические связи и молекулярные структуры.
Понимание орбиталей необходимо для того чтобы понять химические процессы на молекулярном уровне и предсказывать их характеристики. Изучение орбиталей является одним из ключевых аспектов химической теории и помогает строить модели атомов и молекул, а также предсказывать их свойства.
Орбиталь в химии
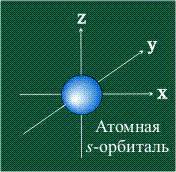
Орбитали являются основными строительными элементами атома. Они характеризуются формой, размером и ориентацией в пространстве. В зависимости от формы орбиталей различают s-, p-, d- и f-орбитали.
Квантовая теория позволяет описывать орбитали и их свойства с высокой точностью. Орбитали задают энергетические уровни электронов в атоме, их взаимодействие и химическое поведение.
Определение орбитали
Основные понятия орбиталей
Орбитали представляют собой области пространства, где вероятность нахождения электрона в атоме или молекуле достаточно высока.
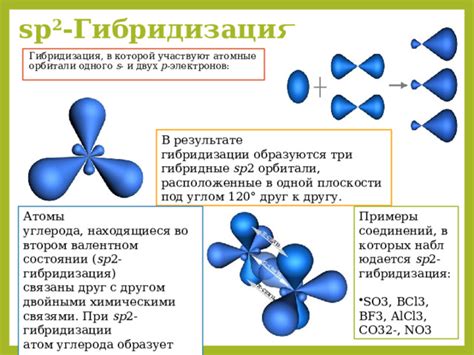
Существует несколько типов орбиталей, таких как s-орбитали (sphericales), p-орбитали (перпендикулярные), d-орбитали (diffuse), которые отличаются формой и ориентацией в пространстве.
Орбитали имеют энергетические уровни, которые определяются принципами квантовой механики. Энергетический уровень орбитали определяет, сколько электронов может быть в ней и их радиус действия.
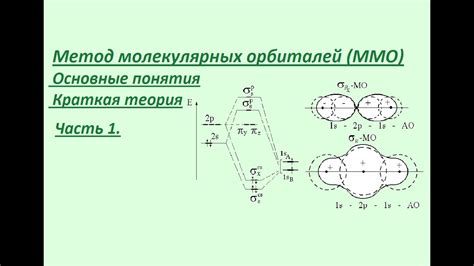
В рамках молекулярной орбитальной теории занимается взаимодействием орбиталей атомов в молекуле и формированием молекулярных орбиталей, определяющих химические связи и структуру молекулы.
Принципы орбитальной теории

Орбитальная теория в химии основана на нескольких основных принципах, которые помогают объяснить строение атомов и молекул:
- Принцип взаимодействия орбиталей: орбитали могут перекрываться и взаимодействовать друг с другом, образуя новые орбитали.
- Принцип заполнения орбиталей: электроны заполняют орбитали по принципу минимальной энергии, сначала заполняя орбитали с меньшей энергией.
- Принцип Паули: в одной орбитали могут находиться максимум два электрона с противоположным спином.
- Принцип исключения Паули: в молекулах электроны стараются находиться в таких орбиталях, чтобы их спины были параллельны.
Эти принципы позволяют лучше понять строение молекул и предсказывать химические свойства веществ.
Вопрос-ответ

Что такое орбиталь в химии?
Орбиталь в химии – это область пространства вокруг атомного ядра, где с наибольшей вероятностью можно найти электрон. Орбитали используются для описания движения электронов в атоме и молекуле.
Какие основные принципы лежат в основе орбиталей?
Орбитали в химии подчиняются нескольким базовым принципам, включая принципы квантовой механики, принципы заполнения электронных оболочек и принципы взаимодействия между орбиталями при образовании связей в молекулах.