В науке имеются понятия, которые, несмотря на свою повседневную употребляемость, оказываются малоизвестными в своей сущности. Знакомство с явлениями, скрытыми за обыденными терминами, может способствовать пониманию окружающего мира и открывать интересные перспективы для практического применения. В этой статье мы рассмотрим два таких понятия - кислоты и щелочи, которые сочетают в себе тайны, привлекательность и важность в химической науке.
Одна из изначальных философских проблем, возникающих при изучении кислот и щелочей, состоит в определении сути этих веществ. Иmеются множество определений и классификаций, которые отражают различные аспекты их свойств: от поведения в растворах до их влияния на органические и неорганические процессы. Обычно мы ассоциируем кислоты и щелочи с привычными понятиями о жидкостях или веществах, но их химический аромат укрыт от нашего ежедневного восприятия и требует глубокого погружения в мир химии.
Таким образом, основной задачей данной статьи является прояснение роли кислот и щелочей в различных процессах и лучшее понимание их значимости в химической науке. Необходимо разобраться в сути их взаимодействия, чтобы понять, как они определяют многие аспекты нашей жизни и окружающей среды. Для этого рассмотрим ключевые отличительные черты этих веществ, их уникальные свойства и роль в различных областях, от медицины до промышленности.
Понятие кислоты в химии
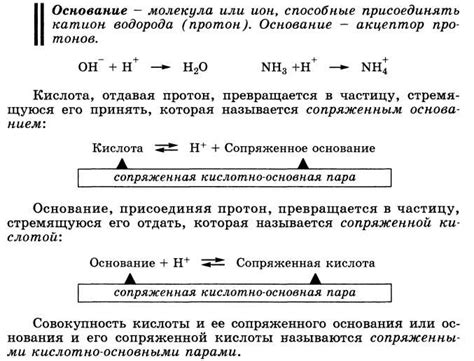
- Кислоты характеризуются способностью образовывать ион водорода в водном растворе. Этот ион, известный как протон, является основным участником реакций кислот.
- Кислоты могут быть органическими или неорганическими. Органические кислоты содержат углерод в своей структуре и имеют широкий спектр применений, включая производство пищевых продуктов и лекарств. Неорганические кислоты, такие как серная, соляная или азотная кислоты, характеризуются использованием в промышленности и химических лабораториях.
- Кислотные реакции обычно сопровождаются особыми признаками, такими как образование пузырьков газа или выделение тепла. Эти реакции могут происходить с другими кислотами, металлами или щелочами.
- Одно из важнейших свойств кислот - их кислотность, которая измеряется на шкале pH. Кислотные растворы имеют значение pH ниже 7, причем более низкое значение соответствует более кислому раствору.
Все эти особенности кислоты делают ее важным объектом исследования и анализа в химии. Понимание понятия кислоты и ее свойств позволяет увидеть широкий спектр возможностей и применений в различных областях науки и техники.
Основные характеристики кислотных веществ
Первое важное свойство кислот - это их кислотность. Кислоты способны выделять водородные ионы в водном растворе, проявляя кислотные свойства. Кроме того, кислоты могут реагировать с определенными компонентами и образовывать соли или соединения с щелочами, что дает множество возможностей для получения новых веществ и материалов.
Вторым важным свойством кислот является их реактивность. Кислоты, взаимодействуя с другими веществами, могут вызывать химические реакции и изменения состояния их структуры. Это свойство позволяет использовать кислоты в различных процессах, таких как нейтрализация, окисление и превращение одних веществ в другие.
Третьим свойством кислот является их влияние на pH-уровень растворов. Кислоты способны изменять кислотно-щелочной баланс растворов, делая их более кислыми. Это имеет важное значение при изучении и контроле процессов в биологии, медицине и окружающей среде.
Примеры соединений, проявляющих свойства кислот

Соляная кислота – один из наиболее известных примеров кислотных соединений. Она обладает раздражающим запахом и имеет характерную желтоватую окраску. Соляная кислота широко используется в промышленности, а также в лабораториях для различных химических процессов.
Уксусная кислота является еще одним примером кислотного соединения. Она получается путем ферментации различных органических веществ, таких как яблочный сок и спирт. Уксусная кислота используется в пищевой промышленности, для консервации продуктов, а также в медицине.
Серная кислота – кислотное соединение, обладающее высокой степенью коррозии. Она имеет ярко выраженные деструктивные свойства и широко применяется в промышленности для различных химических процессов, в том числе для синтеза ряда веществ.
Приведенные примеры лишь небольшая часть разнообразия кислотных соединений. Они демонстрируют различные свойства кислот и их применение в различных сферах жизни. Понимание этих свойств позволяет проводить более глубокое исследование и применение кислотных соединений.
Основы химии: понимание сущности щелочей

Щелочи относятся к классу важных химических соединений, которые обладают рядом уникальных свойств. Они часто используются в промышленности и лабораторных исследованиях. Химическая реакция щелочей с другими веществами может быть классифицирована как щелочная. Одним из ключевых свойств щелочей является их способность нейтрализовать кислоты. Это связано с высоким уровнем основности щелочей.
В качестве основных компонентов щелочей выступают специфические группы химических элементов, например, гидроксид натрия (NaOH) и гидроксид калия (KOH). Они обладают базовыми свойствами, что позволяет им образовывать ионы гидроксида (OH-) при растворении в воде. Гидроксидные ионы являются основными компонентами, которые обуславливают реактивность и основность щелочей.
- Щелочи обычно имеют гладкую и мыльную текстуру.
- Они реагируют с кислотами, образуя соль и воду в химической реакции, которую называют нейтрализацией.
- Щелочи способны разрушать жировые и белковые соединения, что объясняет их широкое использование в бытовых и промышленных продуктах для уборки и очистки.
- В растворе щелочи обладают электролитическими свойствами, что делает их отличными проводниками электрического тока.
- Кроме того, щелочи могут изменять pH-уровень в растворе, делая его менее кислым и более основным.
Сущность баз: важнейшие атрибуты веществ с щелочными свойствами

В химии существует класс веществ, которые, в отличие от кислот, обладают щелочными свойствами. Эти соединения играют значимую роль во многих химических процессах и широко используются в нашей повседневной жизни. Важно учитывать, что основные свойства щелочей, в отличие от кислот, связаны с их поведением в реакциях и их влиянием на окружающую среду.
Высокая щелочность является главным свойством баз. Это означает, что они обладают способностью нейтрализовать кислоты. Действия щелочей направлены на осаждение ионов водорода, которые являются основным признаком кислот. База может изменить процесс окисления-восстановления путем принятия либо отдачи электрона. Зачастую этот процесс происходит в среде со средней и высокой влажностью.
Ещё одной характерной чертой щелочей является их способность образовывать гидроксиды. Они состоят из иона гидроксила (OH-) и обладают щелочными свойствами. Важно учесть, что гидроксиды, как и кислоты, обладают определенной степенью реакционной активности. Они могут образовывать соли путем взаимодействия с кислотами. Гидроксиды щелочей являются основой множества важных процессов в природе и промышленности, от чистки поверхностей до водоочистки.
Алкалиметрические реакции являются специфической особенностью баз. Данные реакции включают использование щелочных соединений для титрования кислот. Этот процесс позволяет определить концентрацию кислоты в растворе и играет важную роль в химическом анализе. Алкалиметрические реакции широко применяются в фармацевтике, пищевой промышленности и других отраслях с целью контроля качества и получения необходимых результатов.
Примеры веществ, обладающих щелочными свойствами

Ряды соединений, которые отнесены к категории щелочных веществ, могут быть найдены в различных областях нашей повседневной жизни. Эти соединения обладают определенными химическими свойствами, которые обеспечивают им уникальные функции и применения.
Один из примеров щелочных соединений - гидроксиды, содержащие группу ОН-. Распространенным представителем этой группы является натриевый гидроксид (NaOH), также известный как щелочь. Натриевый гидроксид широко используется в производстве мыла, бумаги, стекла и различных товаров народного потребления. Его щелочные свойства позволяют его использовать также в качестве отдушки и регулятора pH в различных промышленных процессах.
Еще одним примером щелочного соединения является аммиак (NH3). Этот газ, который характеризуется резким запахом, широко используется в бытовых чистящих средствах и удобрениях. Аммиак также является важным сырьем для производства различных химических соединений, включая удобрения, красители и лекарства. Благодаря своим щелочным свойствам, аммиак может реагировать с кислотами, образуя соли и воду.
Не менее важным примером щелочного соединения является гидрокарбонат натрия (NaHCO3), также известный как пищевая сода. Это вещество широко применяется в кулинарии как разрыхлитель теста, а также в бытовой и медицинской сфере. Благодаря своим щелочным свойствам, гидрокарбонат натрия может использоваться для нейтрализации действия кислот, причем это свойство находит применение как в процессе приготовления пищи, так и в лечении некоторых заболеваний, связанных с повышенной кислотностью.
Сопоставление кислот и щелочей: существенные различия и воздействие на окружающую среду

Этот раздел рассмотрит основные особенности кислот и щелочей, без прямого использования данных терминов. Будут описаны индивидуальные свойства каждого типа веществ, а также их влияние на окружающую среду.
- Кислоты и щелочи имеют существенные отличия в своей химической структуре и реакционной способности.
- Кислоты обладают кислотными свойствами и оказывают кислотное влияние на вещества вокруг них. Они обычно имеют кислый вкус и способны реагировать с металлами, проявляя выделение водорода и образуя соли.
- Щелочи, напротив, обладают щелочными свойствами и проявляют щелочное воздействие на другие вещества. Они обычно имеют горький вкус и способны растворять жиры и масла.
- Влияние кислот и щелочей на окружающую среду может быть разнообразным. Некоторые кислоты могут приводить к коррозии материалов и загрязнению почвы и воды, в то время как некоторые щелочи могут вызывать вредные эффекты на организмы и окружающую природу.
Сравнение кислот и щелочей позволяет лучше понять их различия и важность их влияния на окружающую среду. Понимание этих особенностей позволяет разработать меры для более безопасного обращения с такими веществами и минимизации их негативного воздействия на окружающую среду.
Вопрос-ответ

Какие основные различия между кислотой и щелочью в химии?
Кислоты и щелочи отличаются по своим химическим свойствам и структуре. Кислоты обычно обладают кислым вкусом, способны реагировать с металлами, образуя соли, а также изменять окраску индикаторов. В то время как щелочи имеют щелочной вкус, образуют соли с кислотами и способны изменять окраску индикаторов в противоположную сторону.
Какие свойства обладают кислоты?
Кислоты являются веществами, которые обладают кислотным вкусом, способны реагировать с металлами, образуя соли, а также изменять окраску индикаторов в кислую сторону. Они также обладают способностью отдавать протоны (водородные ионы) в реакциях.
Какие свойства обладают щелочи?
Щелочи имеют щелочной вкус и образуют соли с кислотами в химических реакциях. Они также способны изменять окраску индикаторов в щелочную сторону. Щелочами являются гидроксиды, ионы которых обладают способностью принимать протоны (водородные ионы) в реакциях.
Каковы примеры кислот в химии?
Примерами кислот являются соляная кислота (HCl), серная кислота (H2SO4), уксусная кислота (CH3COOH), фосфорная кислота (H3PO4) и многие другие. Кислоты описываются формулой HX, где Х - анион, который способен принять протон от водородной группы.
Каковы примеры щелочей в химии?
Примерами щелочей являются гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид аммония (NH4OH) и многие другие. Щелочи обозначаются формулами MOH или M(OH)2, где М - металл.
Чем отличается кислота от щелочи в химии?
Кислоты и щелочи - это два основных вида химических соединений, которые различаются своими свойствами и реакциями. Кислоты обладают кислотными свойствами, они способны выделять положительные ионы в воде, образуя водородные ионы (H+). Щелочи (основания), напротив, обладают щелочными свойствами, они способны выделять отрицательные ионы в воде, образуя гидроксидные ионы (OH-). Таким образом, главное отличие между кислотами и щелочами заключается в типе ионов, которые они выделяют в растворе.



